Premières observations de lotus (Nelumbo nucifera Gaertn., 1788) en région Grand-Est
Introduction

Figure 1 : Localisation des observations de Nelumbo nucifera dans le département des Vosges © OFB SD 88
Courant 2020, des observations d’une plante aquatique aisément reconnaissable à son très large feuillage et ses fleurs jugées très esthétiques ont permis de valider la présence de lotus (Nelumbo nucifera) dans trois petits plans d’eau du département des Vosges (88). Ils sont situés dans la région naturelle des basses Vosges (figure 1) à des altitudes d’environ 375 m pour deux plans d’eau voisins dans la commune de Grandvillers et 330 m pour le troisième, dans la commune de Chantraine, proche de la ville d’Épinal.
Situés dans un environnement agricole et forestier, les deux plans d’eau de Grandvillers sont des étangs de pêche privés très proches l’un de l’autre. Le ruisseau des Roseaux qui les alimente est d’une largeur de 1 m et conflue 5,5 km plus en aval avec le ruisseau de Dracourt, un sous-affluent de la Mortagne, elle-même sous-affluent de la Moselle. Ces étangs sont peu profonds (1,5 m maximum). Les deux plans d’eau, celui de l’amont de 4 500 m² (figure 2) et celui de l’aval de 2 300 m², abritent respectivement des herbiers de 300 et 150 m².
Assez fréquenté par les promeneurs, le plan d’eau de Chantraine est un étang communal de pêche, situé en zone périurbaine à proximité d’une zone commerciale. D’une superficie d’environ 9 500 m², il est relativement peu profond environ et la zone colonisée en queue d’étang par le lotus (figure 3) est d’environ 350 m². Situé à l’extrémité d’un lieu de promenade apprécié de nombreux habitants d’Épinal, il a été créé par un barrage du ruisseau “le Grandrupt”, comportant également plusieurs petits étangs privés en amont, tous dépourvus de N. nucifera. D’une largeur de 1,5 à 2 m, le ruisseau rejoint la Moselle 3,5 km en aval.
Les dates d’introduction des plantes dans ces trois étangs ne nous sont pas connues, ni d’ailleurs les personnes responsables. Compte-tenu de leurs superficies et de la relative densité de leurs herbiers, elles doivent y être présentes depuis quelques années.
A notre connaissance, les observations de cette espèce en Lorraine sont les plus septentrionales en métropole.
Synthèse des connaissances sur l’espèce
Répartition du genre Nelumbo et statuts de N. nucifera
Appartenant à la famille des Nelumbonaceae, le genre Nelumbo (Adans., 1763) comporte deux espèces, Nelumbo lutea et N. nucifera, dont la seconde est connue dans le monde entier pour son esthétique et son intérêt ornemental, mais aussi pour un ensemble de liens très anciens avec des religions orientales comme le bouddhisme et le brahmanisme qui en ont fait une fleur sacrée. Nelumbo nucifera est de plus la fleur nationale de l’Inde et du Vietnam.
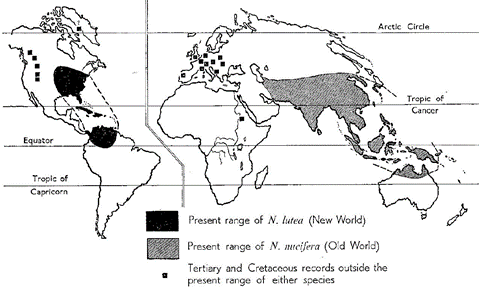
Les deux espèces du genre ont une répartition naturelle mondiale bien séparée, comme le montre la carte de Sculthorpe (1967) : N. lutea sur le continent américain et N. nucifera sur l’ensemble eurasien, depuis la mer Caspienne jusqu’en Chine (figure 4). Des fossiles de ces deux espèces ont été répertoriés, indiquant les évolutions à très long terme de cette répartition, dont des traces de N. nucifera sur le continent européen.
A l’heure actuelle, elles se rencontrent toutes deux principalement dans les zones inter tropicales du globe mais sont également présentes au-delà, en particulier dans les zones tempérées Nord.
L’intérêt horticole de N. nucifera a fortement contribué à sa dispersion sur une grande partie de la planète, ainsi que l’indique la carte de sa répartition actuelle présentée par le Système mondial d’information sur la biodiversité (figure 5).
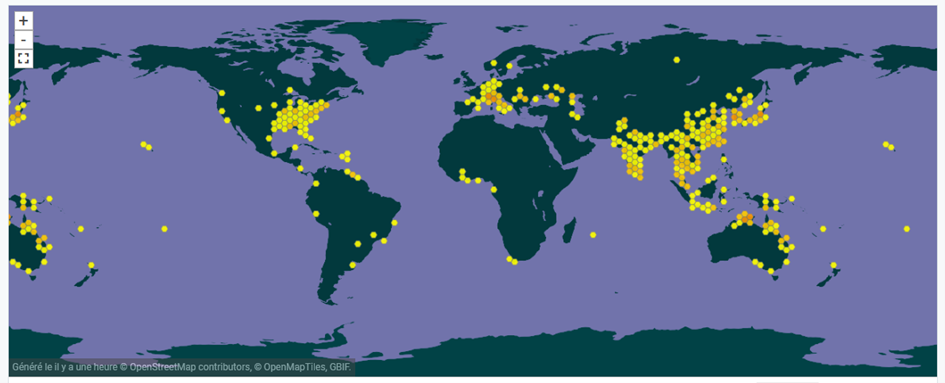
Figure 5 : répartition mondiale de N. nucifera (GBIF.org, 2021)
Selon cette base d’informations, l’espèce est enregistrée comme envahissante dans les 8 pays et îles suivants : États-Unis d’Amérique, Guyane, Iles Cook, Indonésie, Italie, Malaisie, Roumanie, Suriname avec des “preuves d’impacts” signalées pour l’Italie et la Malaisie. Elle y est également indiquée comme introduite en Hongrie.
Aux États-Unis où elle coexiste donc avec l’autre espèce, N. nucifera a été introduite dans des étangs et lacs dans au moins une quinzaine d’états du Sud et de l’Est, depuis la Floride et le Texas au sud jusqu’au Wisconsin et l’Illinois au nord dans la région des grands lacs. Elle figure à ce titre dans la liste des plantes introduites du département américain de l’Agriculture. Cependant, elle n’est pas citée comme espèce exotique envahissante à l’échelle des États-Unis dans une liste de 50 plantes aquatiques présentée dans un Atlas des plantes envahissantes des États-Unis, alors que le lotus indigène N. lutea, y figure en raison de sa dispersion hors de son aire naturelle. En revanche, le système d’évaluation du risque lié aux mauvaises herbes d’Hawaï (“Hawai Weed Risk Assessment System“) classe l’espèce comme une espèce exotique envahissante en lui attribuant un score de 14, soit un “Haut risque”.
Il est très probable que sa dispersion mondiale actuelle permette à cette espèce de coloniser les milieux aquatiques d’autres territoires et que cette liste de pays où lui est attribué un statut concernant ses capacités d’invasion continue de s’allonger. Par exemple, sur le continent africain, elle est répertoriée en Côte d’Ivoire comme une plante exotique envahissante, introduite pour l’ornement (Neuba et al., 2014) et des observations plus anciennes faisaient déjà état de sa dynamique de colonisation (N’dah & Arfi, 1996).
En ce qui concerne l’Italie, dans une page du site du Fonds Mondial pour la Nature (WWF) consacrée à l’écorégion “Italie du Nord s’étendant jusqu’au rivage de la mer Adriatique”, N. nucifera est clairement identifiée comme une espèce exotique envahissante agressive à croissance rapide (“a fast-growing, aggressive exotic plant“) menaçant la flore et la faune indigènes de cette région. Elle fait partie de la liste noire des espèces végétales allochtones faisant l’objet d’une surveillance, d’un confinement ou d’une éradication, annexe d’une loi régionale lombarde de 2008.
Répartition en France
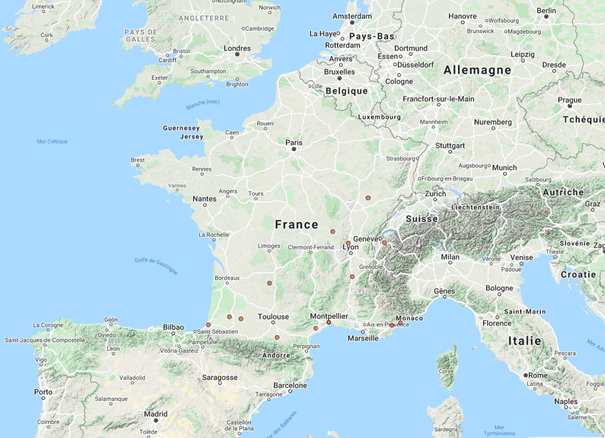
Figure 6 : Localisation des observations de N. nucifera répertoriées en métropole (Source : OpensObs – MNHN, 2021)
Nelumbo nucifera est mentionnée en France depuis le 19ième siècle par l’Abbé Gandoger comme une plante aquatique ornementale prisée des parcs et jardins d’eau. Elle est notée comme un “taxon planté et cultivé des étangs artificialisés” dans la Flore de la France méditerranéenne continentale (Tison et al., 2014) mais n’est pas citée dans Flora Gallica (Tison & De Foucault, 2014).
En France, selon l’INPN, elle est absente des îles de Saint-Barthélemy et de Saint Martin mais présente dans divers territoires avec différents statuts : “introduite” à La Réunion, “introduite envahissante” en Guyane française et “introduite non établie (dont cultivée ou domestique)” en Nouvelle-Calédonie, Polynésie française, Guadeloupe, Martinique et en métropole.
Pour ce qui est de la métropole, une très grande part de la vingtaine de sites d’observations semble correspondre à des Jardins botaniques ou des Parcs floraux, pour la plupart situés dans le sud et le sud-est (Figure 6). Le site le plus au Nord se trouve dans la commune de Battrans (70), proche de Gray, commune où se trouve un de ces jardins botaniques.
Dans les informations disponibles sur les sites de présence de l’espèce, on peut toutefois noter l’absence de référencement du parc floral de La Court d’Aron (Vendée) qui en fait pourtant sa plante emblématique et l’élément attractif de visite.
Ces localisations correspondant à des sites d’implantation volontaires expliquent le statut actuellement attribué à l’espèce en métropole. Les présentes observations en Lorraine dans des plans d’eau aux usages de loisir ne semblent pas devoir changer cette situation.
Caractéristiques biologiques et écologiques de l’espèce
Plante aquatique pouvant coloniser le bord des eaux jusqu’à des profondeurs pouvant dépasser 2 mètres (jusqu’à 3 m), N. nucifera est particulièrement reconnaissable à ses feuilles, ses fleurs et ses fruits.
D’un diamètre pouvant atteindre 80 cm et de couleur vert glauque avec un aspect cireux, ses feuilles sont peltées, c’est-à-dire pourvue d’un pétiole attaché au centre du limbe. Ce pétiole peut mesurer jusqu’à 2 mètres de longueur et porter des feuilles souvent en forme de coupe érigées hors de l’eau jusqu’à 75 cm, pouvant aussi rester flottantes et planes. Par ailleurs, le limbe de ces feuilles est “hyper-hydrophobe”, c’est-à-dire que les gouttes d’eau ne peuvent s’y accrocher, permettant aux feuilles de rester également dépourvues de poussières et donc de risques de pertes de capacités photosynthétiques : des recherches en biomimétisme sur cet “effet lotus” ont déjà permis de développer différents matériaux tels que des vitres autonettoyantes, des peintures anti-salissures ou des revêtements antibactériens (voir par exemple).
La taille et l’esthétique des fleurs expliquent une très grande part de l’intérêt qui a été porté à l’espèce par de multiples populations humaines depuis des siècles. Parfumées (une odeur anisée), présentant la particularité d’une régulation de leur température et mesurant de 15 à 35 cm de diamètre, elles comportent une vingtaine de pétales concaves de couleur blanc rosé. Elles sont isolées à l’extrémité d’un pédoncule très long pouvant dépasser les feuilles les plus hautes. Elles comportent de très nombreuses étamines.
D’un diamètre pouvant atteindre à maturité une dizaine de centimètres, le “fruit” ressemble à une pomme d’arrosoir, avec une surface latérale striée, une base arrondie et un sommet aplati (figure 7). Le sommet de ce qui est en fait d’un “faux fruit”, car non directement issu de la transformation du pistil de la fleur, montre 15 à 30 alvéoles renfermant chacune un akène (un fruit sec à graine unique) de la taille d’une petite noisette.

Figure 7 : Réceptacle floral en forme de pomme d’arrosoir renfermant les graines de N. nucifera © Michel Stoecklin/Nil Godé OFB 88
Ces graines présentent également une particularité qui a depuis très longtemps attiré l’attention sur elles : leur longévité. Elles semblent en effet détenir le record dans ce domaine car une équipe de recherches a pu faire germer une graine datant d’environ 1 300 ans provenant d’un ancien lac de l’est de la Chine (Shen-Miller et al., 1995 ; Shen-Miller, 2002). Cette longévité semble due à l’enveloppe très résistante de la graine.
La plante développe des rhizomes intra-sédimentaires ramifiés assurant sa reproduction végétative qui peut se poursuivre tant qu’ils ne sont pas eux même atteint par le gel hivernal, alors que toutes ses parties aériennes disparaissent durant l’hiver. Il semble cependant que son développement au printemps et en été nécessite des eaux suffisamment chaudes pour se produire, ce qui est plus facile dans les eaux peu profondes du bord des eaux en régions tempérées, y compris sous un climat continental aux hivers longs et froids. De couleur blanc jaunâtre à brun jaunâtre, striés longitudinalement et présentant des nœuds, ces rhizomes mesurent 60 à 140 cm de longueur avec un diamètre pouvant atteindre 2,5 cm (Mukherjee et al., 1996). Ils semblent avoir une durée de viabilité dépassant 50 ans (Perveen & Mir, 2019).
Usages
Si son esthétique mondialement appréciée en fait une espèce horticole de prestige expliquant sa dispersion, cette espèce est considérée par de nombreux humains comme importante ou utile pour diverses autres raisons.
Selon Sheikh (2014), le lotus cultivé depuis environ 7 000 ans en Asie extrême-orientale y est très largement utilisé pour l’alimentation et la médecine traditionnelle. L’espèce est par ailleurs considérée comme sacrées dans plusieurs religions, “symbole de la pureté, de la beauté divine, de la résurrection et de l’illumination“.
L’espèce est un des aliments régulièrement consommé par diverses populations humaines, en particulier en Inde et au Cachemire, mais aussi en Chine, en Corée, au Japon et dans d’autres pays de cette partie du monde. En effet, plante riche en amidon, vitamines, protéines, minéraux, fibres et divers composés bioactifs comme des alcaloïdes ou des flavonoïdes, toutes ses parties, rhizomes, pétioles, jeunes feuilles, fleurs et graines sont comestibles. Le rhizome peut être consommé comme légume, cru ou cuit, dans de très nombreuses préparations ou, après extraction de son amidon, être utilisé dans la composition de potages, de boissons, etc. Les graines peuvent également être consommées crues ou cuites et incorporées comme ingrédient dans diverses pâtisseries et desserts traditionnels. La consommation crue n’est pas recommandée à cause de risques de transmission de parasites.
Diverses parties du lotus comme les bourgeons, les fleurs, les anthères, les étamines, les fruits, les feuilles, les tiges, les rhizomes et les racines ont été utilisées depuis très longtemps en médecine traditionnelle chinoise et ayurvéda. Il s’agissait de traiter de très nombreuses affections ou maladies comme les insolations, la diarrhée, la dysenterie, les hémorroïdes, les vertiges, les vomissements de sang, les troubles hémorragiques utérins, mais aussi de favoriser la conception, améliorer l’état de la peau, contrôler les sensations de brûlure, les infections, la toux, l’hypertension, la fièvre, les problèmes urinaires, etc. De nombreuses études pharmacologiques ont prouvé ses activités antidiarrhéiques, anti-inflammatoires, antipyrétiques, hypoglycémiques, immunomodulatrices, psychopharmacologiques, antioxydantes, aphrodisiaques, lipolytiques, antivirales, anticancéreuses et hépatoprotectrices (Mehta et al., 2013).
Bien que de nombreuses recherches se poursuivent toujours dans ce domaine, les connaissances acquises sur cette espèce ont déjà permis à des chercheurs, tels que Sridhar & Rajeev (2007), d’en faire une présentation comme d’une plante neutraceutique potentielle (c’est-à-dire “un aliment qui soigne”) pouvant aider à combattre la malnutrition dans les pays en développement. Se référant au vaste potentiel de la plante dans le domaine pharmacologique, ces deux auteurs concluent leur article en insistant à la fois sur les nécessités de la poursuite de ces recherches et de la conservation de cette espèce menacée par les impacts des activités humaines, dont la pollution de ses habitats.
A titre d’exemple, une enquête menée à l’échelle de la Thaïlande (La-ongsri et al., 2009) sur la gestion et les utilisations de N. nucifera dans près de soixante zones humides du pays a permis de lister une vingtaine d’usages différents de la plante, principalement pour l’alimentation, la médecine et les rites religieux, démontrant son utilisation sur l’ensemble du territoire.
Impacts et nuisances
Dans les biotopes favorables, N. nucifera peut constituer des colonies très denses pouvant assez facilement éliminer les autres macrophytes par l’ombrage créé par ses larges feuilles. L’occupation de la colonne d’eau par ses pétioles et pédoncules floraux peut également créer des nuisances à certains usages des zones colonisées.
Cette capacité de colonisation n’est évidemment pas une contrainte ou un risque dans les régions du monde où la plante est utilisée pour l’alimentation ou ses composés pharmaceutiques utiles. En revanche là où son introduction a été faite pour des raisons horticoles, il n’en est pas toujours de même. Par exemple, dans les mares et les lacs de Côte d’Ivoire, selon Guiral & N’Da (1994), N. nucifera fait partie des plantes aquatiques exotiques envahissantes responsables de dégâts à la navigation, aux systèmes aquacoles traditionnels, etc.
La rapidité du développement de l’espèce après son introduction pour des raisons esthétiques dans des petits plans d’eau peut également surprendre : par exemple, dans une page internet du site de l’Université d’Etat de l’Ohio qu’il a intitulée “Sacred Lotus May Not Be So Sacred“, J. Boggs s’étonne de la rapidité avec laquelle deux petits étangs ont été complètement colonisés entre 2014 et 2019. Les photos qui illustrent cette page sont tout à fait explicites. Constatant que cette introduction et ses conséquences est une répétition de nombreuses invasions provoquées par les meilleures intentions, il conclut le texte de cette page par une citation issue du film “Jurassic Park”, où le Dr Ian Malcolm (Jeff Goldblum) dit : “Oooh, ahhh,” that’s how it always starts. But then later there’s running and then screaming.” (c’est toujours comme ça que ça commence. Mais ensuite, plus tard, il y a la course et puis les cris).
Aux États-Unis, divers états du sud-est ont signalé des naturalisations de l’espèce en dehors de sites de plantations, dans des petits plans d’eau et des zones peu profondes de lacs et de rivières, par exemple en Ohio, en Virginie occidentale, au New Jersey et à New York, mais la recherche bibliographique ne nous a pas permis de rassembler d’informations précises.
En Europe : le cas de l’Italie
Des informations sur des nuisances et des interventions de gestion de N. nucifera dans la région Lombardie (Italie) permettent toutefois d’apporter quelques compléments issus de résultats de recherche.
 Dans un rapport de 2017 (Parc naturel régional du Mincio, 2017) présentant les modalités de gestion de Trapa natans et de Nelumbo nucifera dans les lacs de Mantoue, et en particulier dans les Sites Natura 2000 et les Réserves Naturelles des Vallées du Mincio et de Vallazza, figurent des indications très claires sur les nécessités de cette gestion de N. nucifera.
Dans un rapport de 2017 (Parc naturel régional du Mincio, 2017) présentant les modalités de gestion de Trapa natans et de Nelumbo nucifera dans les lacs de Mantoue, et en particulier dans les Sites Natura 2000 et les Réserves Naturelles des Vallées du Mincio et de Vallazza, figurent des indications très claires sur les nécessités de cette gestion de N. nucifera.
Malgré sa valeur ornementale, il est indiqué que la présence de l’espèce dans les lacs de Mantoue est à considérer comme résolument négative. Situés en zones urbaines, ces trois lacs fluviaux peu profonds (profondeur moyenne : 3,5 m), lacs Supérieur, Moyen et Inférieur, ont été progressivement colonisés par N. nucifera après son introduction dans les années 20, en particulier dans le lac Supérieur où la plante forme deux grandes “îles de macrophytes”.
Elle y remplace la végétation indigène immergée et flottante en réduisant la lumière dans les eaux, tend à occuper les zones d’eau libre peu profondes, colonisant les zones de roselières, ce qui prive les habitats de réserves trophiques nécessaires à diverses espèces d’oiseaux qui devraient y trouver leur régime alimentaire. Il est également indiqué que l’espèce est tout à fait inadéquate pour supporter les nids flottants des oiseaux présents. Il est enfin précisé qu’il est souhaitable d’éliminer l’espèce de toute la zone de la ZPS Valli del Mincio, englobant tous ces milieux, à l’exception de quelques petites zones qui devront être situées en dehors de la réserve naturelle.
Des recherches sur les caractéristiques des espèces exotiques pouvant expliquer leurs capacités d’invasion se poursuivent depuis de nombreuses années. C’est dans ce contexte qu’une étude (Tóth et al., 2019) a été menée sur les lacs de Mantoue pour comparer les traits physiologiques et écologiques de deux espèces de macrophytes introduites (N. nucifera et Ludwigia hexapetala) et de trois espèces indigènes (Nuphar lutea, Nymphaea alba et Trapa natans). La comparaison entre espèces a montré pour les deux espèces exotiques une efficacité photosynthétique plus importante, des teneurs plus élevées en chlorophylle a et b, et en caroténoïdes, induisant des taux de croissance plus rapides et une plus forte productivité. La saison de croissance de ces deux espèces s’est également avérée être plus longue que celle des espèces indigènes, se poursuivant au-dessus des eaux jusqu’à fin octobre – mi-novembre, avec par exemple une durée de plus de 170 jours pour N. nucifera. Les auteurs notent également un avantage morphologique pour cette espèce, sa surface foliaire pouvant atteindre 1,5 m².
Par ailleurs, une étude de Mastrantuono & Mancinelli (1999) montre entre 1966 et 1994 des modifications importantes de la végétation immergée et de la faune d’invertébrés du lac de Monterosi. D’une superficie de 0,32 km² et d’une profondeur maximale de 4,5 m, ce lac volcanique est situé au nord de Rome à une altitude de 239 m. Un premier bilan sur les communautés de macrophytes réalisé en 1986 (Scoppola & Avena, 1987) avait montré une colonisation d’un partie réduite des rives du lac par N. nucifera à la suite d’une introduction de l’espèce pour des raisons ornementales.
Cette colonisation a montré une très forte dynamique en quelques années puisqu’en 1994 plus de la moitié des zones riveraines du lac étaient colonisées par N. nucifera, induisant une très nette régression de la diversité des macrophytes aquatiques, passée de 12 taxons en 1966 à 6 taxons, et des modifications importantes des abondances relatives des espèces indigènes. Les analyses menées par les auteures sur la faune d’invertébrés associée aux macrophytes ont montré qu’elle restait relativement diversifiée et apparemment positivement influencée par la relative abondance des macrophytes, cependant des effets négatifs notables de la colonisation par N. nucifera sur cette faune ont été clairement mis en évidence. En effet, dans les zones monospécifiques colonisées, les importantes diminutions observées de la richesse taxonomique et du nombre d’invertébrés ont été attribuées par les auteures à l’absence de feuilles immergées de la plante, ce qui réduit considérablement la surface végétale utilisable par les invertébrés.
Interventions de gestion
L’historique de l’introduction et de la dispersion ultérieure de Nelumbo nucifera est bien connue en Lombardie. Cultivée depuis le début du 19ème siècle au Jardin Botanique de Parme, l’espèce a été délibérément introduite dans les lacs de Mantoue en 1921. Elle est actuellement présente dans plusieurs lacs (Mantoue, Varèse, Crémone, Comabbio), dans des zones humides comme les marais de Brabbia, dans divers plans d’eau et carrières en eau, bras morts de cours d’eau, etc., dans les plaines et collines de la région à des altitudes inférieures à 100 m (Banfi & Galasso, 2010).
Selon ces auteurs, si les premières introductions avaient pour objectif les intérêts alimentaires ou pharmaceutique de la plante, sa dispersion ultérieure a été liée à son intérêt horticole. Selon eux, les mesures de gestion proposées à l’époque étaient classiquement de la prévention, en particulier dans les zones à risques, invitant producteurs et clients à renoncer à l’utilisation de cette plante ornementale pour la remplacer par d’autres, et des coupes sélectives avant la floraison, répétées durant plusieurs années.
Le rapport du Parc naturel régional du Mincio sur la gestion de Nelumbo dans les lacs de Mantoue et les réserves naturelles proches précise les sites dans lesquels devra intervenir un fauchage des feuilles sous la surface de l’eau, à réaliser de mai à septembre au moyen d’un bateau équipé d’une barre de fauchage. La fauche sera répétée dès la réémergence des feuilles, afin d’empêcher le développement de la plante et provoquer une consommation des substances de réserve accumulées dans les rhizomes pour arriver à épuiser la plante. Il est également indiqué que les interventions sur les jeunes feuilles permettront d’éviter la collecte du matériel fauché compte tenu de la masse réduite de la végétation coupée.
Le premier fauchage devrait être effectué en mai, suivi de deux/trois autres opérations de coupe en juillet et août. L’ouverture de canaux à l’intérieur des grandes îles de N. nucifera est également préconisée pour favoriser l’écoulement des eaux.
Un rapport technique final de suivi d’un protocole de gestion de Nelumbo nucifera dans une Réserve Naturelle proche du lac de Varèse (Riserva Palude Brabbia), présente le protocole expérimental mis en place et les résultats de deux années de suivi en 2016 et 2017 (Bruso, 2018). Les interventions de fauche sur ces secteurs (figure 8) avaient débuté durant l’été 2013 (Idrogea, 2015) et ont été répétées en 2014 selon des calendriers différents (une à deux fauches par an en été et/ou en automne). Le suivi de 2016-2017 était destiné à évaluer l’évolution des peuplements de N. nucifera. Trois secteurs expérimentaux et un témoin localisés dans les chenaux de cette réserve ont été suivis en réalisant des estimations de l’abondance de la plante en quatre classes (couverture faible à très abondante) sur trois points d’échantillonnage par parcelle. La densité des feuilles (nombre/mètre²) et le diamètre de 5 feuilles échantillonnées ont été mesurés.
Les observations ont montré que suite aux opérations de fauchage extensif, fin 2017, l’espèce n’était plus présente que dans quelques zones ponctuelles (figure 9) alors que toute la surface des canaux était auparavant complètement couverte.

Figure 9 : position entre eau libre et canopée de deux zones de N. nucifera dans le réseau de canaux (extrait du rapport d’Idrogea, 2015)
L’auteur indique que ces zones proches des berges des canaux ont peut-être échappé à la fauche et rappelle qu’elles conservent un potentiel de colonisation des eaux libres du site n’abritant pas de macrophytes indigènes. Lors des campagnes de suivi, aucun fruit n’a été observé flottant sur l’eau. La disparition de certaines des zones de N. nucifera pourrait également être due à la consommation des plantes par la faune herbivore présente dans le site, dont le Ragondin. Il conclut son rapport en recommandant que des interventions soient réalisées sur les zones encore colonisées durant deux années végétatives non consécutives pour arriver à l’éradication de l’espèce.
Des consommateurs de N. nucifera ?
Différents oiseaux d’eau peuvent consommer les graines de l’espèce, dont par exemple le Canard colvert (Franck & Bellrose, 1941), le Canard souchet ou la Nernache du Canada. Les mammifères herbivores comme le Ragondin peuvent probablement consommer tiges et feuilles, ainsi que l’indique Bruso (2018).
Dans une fiche américaine illustrée présentant l’espèce, des invertébrés s’attaquant au lotus américain (N. lutea) sont cités comme pouvant également concerner N. nucifera : il s’agirait en particulier de chenilles de deux papillons de nuit, Bellura obliqua et Ostrinia penitalis (deux espèces américaines), perçant les pétioles des feuilles et les pédoncules des fleurs. Ostrinia penitalis est d’ailleurs citée par J. Boggs comme s’attaquant aux deux espèces de lotus : sa page présente des photos des chenilles et il commente en spécifiant qu’il ne craint pas de voir ce papillon américain s’attaquer au lotus sacré : I don’t mind seeing our native moth hammering sacred lotus.
Commentaires, en guise de conclusions
Si l’on en croit la carte du Système mondial d’information sur la biodiversité (figure 5), ces premières observations en région Grand-Est ne sont pas les plus septentrionales en Europe, avec quelques sites déjà localisés en Allemagne, en Pologne et en Scandinavie.
Le dérèglement climatique en cours est un facteur favorisant l’implantation, voire la dispersion, de cette espèce capable de supporter des hivers froids tant que les conditions printanières et estivales permettent des réchauffements suffisants des eaux. C’est pour cette même raison qu’a été récemment observé dans un de ces plans d’eau, un autre taxon exotique mais du règne animal, lui aussi réputé pour son expansion géographique, le bryozoaire Pectinatella magnifica (Collas, 2020).
Les usages de cette espèce dans d’autres parties du monde présentés dans cette synthèse (autres que son intérêt horticole) ne doivent pas faire oublier que ses importantes capacités de colonisation de biotopes favorables peuvent causer des dommages écologiques. Des colonies denses de N. nucifera peuvent en effet éliminer les communautés de macrophytes immergées, des plantes à feuilles flottantes comme les nymphéacées ou certains potamots, voire même certains hélophytes comme par exemple la prêle aquatique (Equisetum fluviatile) (figure 2), pouvant alors modifier dans des proportions variables le fonctionnement écologique des plans d’eau fortement colonisés, y compris les relations trophiques avec la faune aquatique ou inféodée.
Hormis leur consommation par des oiseaux, devenant alors de potentiels transporteurs, les graines produites peuvent flotter et être entrainées vers l’aval dans les deux bassins versants distincts à partir des deux cours d’eau (Ruisseau des Roseaux et Le Grandrupt) où se trouvent les plans d’eau, ce qui pourrait faciliter l’expansion de l’espèce dans des biotopes favorables.
Dans le contexte actuel, cette espèce ne semble pas présenter de forte dynamique d’extension en métropole à partir de sites où elle a été plantée et cultivée pour des raisons horticoles. Il n’en reste pas moins que cette espèce aux caractéristiques écologiques très particulières, devrait, au même titre que toutes les espèces exotiques détectées en milieu naturel, faire l’objet d’une surveillance régulière qui puisse, le cas échéant, permettre de réévaluer la situation et décider de la mise en place d’une éventuelle gestion. Dès lors que ses feuilles sont émergées, elle est heureusement suffisamment visible et identifiable dans tout paysage aquatique pour qu’elle ne soit pas ignorée.
Toute nouvelle observation de l’espèce est à signaler à :
En région Grand-Est : Marie Duval, Pôle lorrain du futur CBN Nord-Est (mduval@polelorrain-cbnne.fr)
Dans les Vosges : Michel Stoecklin (michel.stoecklin@ofb.gouv.fr) et Nil Godé (nil.godé@ofb.gouv.fr) Office Français de la Biodiversité
Service départemental des Vosges – Unité territoriale massif, 6, le Moulin, F-88600 Fremifontaine.
Dans les autres régions françaises, vous pouvez contacter le Conservatoire botanique national de votre région.
Il est également possible de signaler l’espèce grâce à l’application INPN-Espèces.
Rédaction : Michel Stoecklin et Nil Godé, OFB SD 88, Alain Dutartre, expert indépendant
Relecture : Madeleine Freudenreich et Emmanuelle Sarat, Comité français de l’UICN
Remerciements : A Marc Collas pour ses conseils et sa relecture ainsi qu’à Frédéric Chambry pour la réalisation de la cartographique vosgienne de l’espèce. A Mélanie Thiébaut et Yves Theillere de l’université Claude-Bernard Lyon 1 pour les vérifications effectuées sur l’herbier “Michel Gandoger”.
Bibliographie
- Banfi E., Galasso G., 2010. La flora esotica Lombarda. Regione Lombarda. Comune di Milano. Museo di Storia Naturale di Milano, 273 pp.
- Brusa G., 2018. Monitoraggio di Nelumbo nucifera (Riserva Palude Brabbia) e di Ludwigia hexapetala (ZPS Lago di Varese). Relazione tecnica finale. LIPU-Provincia di Varese. 33 p.
- Collas M., 2020. Note technique sur la présence d’un bryozoaire allochtone Pectinatella magnifica (LEIDY,1851) dans le département des Vosges en 2020. 7 p.
- Frank C., Bellrose J., 1941. Duck food plants of the illinois River Valley. Bulletin Departement of registration and education. Natural History Survey division. Urbana, Illinois. (21) 8, 50 p.
- Guiral D., N’Da E., 1994. Les macrophytes : In Environnement et ressources aquatiques de la Côte d’Ivoire: les milieux lagunaires. Durand J.-R., Dufour, P., Guiral D. et Zabi, S.G.F (eds), 137-154
- Hilty J., 2020. Wetland Wildflowers of Illinois – Nelumbo nucifera (Sacred Lotus). http://www.illinoiswildflowers.info/. [Accessed 30 Mar. 2021].
- Idrogea Servizi S.r.l., 2013 ; 2014 & 2015. Azione E.2.1: monitoraggio per la valutazione degli effetti di controllo/eradicazione di Nelumbo nucifera presso la riserva Palude Brabbia (azione C.4B) e di Ludwigia haxapetala presso la ZSP Lago di Varese (azione C.4B). Relazione tecnica non pubblicata. Provincia di Varese, Settore Ecologia ed Energia.
- La-ongsri W., Trisonthi C., Balslev H., 2009. Management and use of Nelumbo nucifera Gaertn. in Thai wetlands. Wetlands Ecol Manage, 17 : 279–289
- Li Y.,Smith T., Popova S., Yang J., Jin J-H, Sen Li C, 2014. Paleobiogeography of the lotus plant (Nelumbonaceae: Nelumbo) and its bearing on the paleoclimatic changes, 399; 284–293.
- Mastrantuono L., Mancinelli T., 1999. Long-Term Changes of Zoobenthic Fauna and Submerged Vegetation in the Shallow Lake Monterosi (Italy). Limnologica 29, 160-167
- Mehta N.R., Patel E.P., Patani .P. V., Shah B., 2013. Nelumbo nucifera (Lotus): A Review on Ethanobotany, Phytochemistry and Pharmacology. Indian J Pharm Biol Res, 1 (4) : 152-167
- Mukherjee P. K., Balasubramanian R., SAHA K., SAHA B. P., PAL M. 1996. A review on Nelumbo nucifera Gaertn. Ancient Science of life.(XV), 268 -276.
- N’dah E., Arfi R., 1996. Macrophytes aquatiques dans les eaux continentales ivoiriennes. Centre de Recherches Océanologiques Abidjan, Archives Scientifiques, 15 (2), 26 p.
- NEUBA D.F.R, MALAN D.F., KONÉ M., KOUADIO Y.L., 2014. Inventaire préliminaire des plantes envahissantes de la Côte d’Ivoire. Journal of Animal &Plant Sciences, Abidjan, Vol.22, Issue 2: 3439-3445
- Perveen N., Mir H., 2019. The Sacred Lotus (Nelumbo nucifera): A Blessing to Mankind. Popular Kheti, (7) 4, 17 – 19
- Scoppola A., Avena G., 1987. Indagini ecologico-faunistiche sulle zone umide interne del Lazio. 3: Variazioni cenologiche indotte da Nelumbo nucifera sulle comunità vegetali del Lago di Monterosi. Ann. Bot. 45: 145-156.
- Sculthorpe C. D., 1967. The Biology of Aquatic Vascular Plants. Edward Arnold (Publishers) Ltd. London. xviii + 610 p.
- Sheikh S. A., 2014. Ethno-medicinal uses and pharmacological activities of lotus (Nelumbo nucifera). Journal of Medicinal Plants Studies, 2 (6) : 42-46
- Shen-Miller J. 2002. Sacred lotus, the long-living fruits of China Antique. Seed Science Research 12, 131–143
- Shen-Miller J., Mudgett M.B., Schopf J.W., Clarke S. et Berger R., 1995. – Exceptional seed longevity and robust growth: ancient Sacred Lotus from China. American Journal of Botany, vol. 82, no 11, p. 1367-1380.
- Sridhar K. R., Rajeev B., 2007. Lotus – A potential nutraceutical source. Journal of Agricultural Technology, 3 : 143-155.
- Tison J.M., De Foucault B. (coords), 2014. Flora Gallica. Flore de France. Biotope, Mèze, 1196 p.
- Tison J.M., Jauzein P., Michaud H., 2014. Flore de la France méditerranéenne continentale. Conservatoire Botanique National Méditerranéen. Porquerolles, 2078 p.
- Tóth V.R., Villa P., Pinardi M., Bresciani M., 2019. Aspects of Invasiveness of Ludwigia and Nelumbo in Shallow Temperate Fluvial Lakes. Front. Plant Sci. 10 : 647.
Rédaction : Michel Stoecklin et Nil Godé, OFB SD 88, Alain Dutartre, expert indépendant
Relecture : Madeleine Freudenreich et Emmanuelle Sarat, Comité français de l’UICN