Introduction
Depuis plusieurs décennies, la recherche sur les espèces végétales et animales impliquées dans la propagation des invasions biologiques à l’échelle mondiale a connu une croissance significative et permettent désormais des évaluations internationales partagées. Cependant, des efforts particuliers restent à faire pour le domaine de la mycologie, qui n’a pas encore atteint le même niveau de développement.
En effet, ce n’est que depuis environ une vingtaine d’années qu’une attention particulière aux champignons exotiques s’est développée, grâce à une meilleure disponibilité des données de répartition de ces espèces et au recueil d’informations sur leurs impacts dans les écosystèmes introduits (voir par exemple, Vellinga et al., 2009 ; Nuñez & Dickie, 2014 ; Dickie et al., 2016 ; Monteiro et al., 2020, 2022). Il est aussi à noter que les connaissances sur les impacts des champignons exotiques ont jusqu’à récemment principalement porté sur des taxons pathogènes, souvent microscopiques, étudiés en raison de leur potentiel à causer des maladies sur les plantes et les animaux indigènes (Desprez-Loustau et al., 2007), des dommages sur la production agricole et forestière (Panzavolta et al., 2021) ou des risques pour la santé humaine (Page & Westcott, 2014).
Les espèces de macrochampignons (c’est-à-dire les champignons de grande taille, dont la fructification est visible à l’œil nu) introduites à l’échelle planétaire sont toutefois assez nombreuses et ont été largement transportées au cours des derniers siècles (Desprez-Loustau et al., 2010 ; Monteiro et al., 2022). Parmi elles, beaucoup ont d’ailleurs été déplacées par inadvertance dans le commerce des plantes ou dans le bois mort ou le sol (Vellinga et al., 2009). L’évaluation de leurs impacts dans les zones d’introduction ont porté dans un premier temps sur leurs effets négatifs (Desprez-Loustau et al., 2007), incluant la toxicité pour les humains (French et al., 2011), la compétition avec les champignons indigènes (Murat et al., 2008) ou encore des modifications du fonctionnement des écosystèmes colonisés (Chapela et al., 2001) mais il est intéressant de signaler que les macrochampignons appartiennent à un groupe de taxons exotiques pour lesquels des impacts positifs sont assez régulièrement cités. Parmi ces impacts sont répertoriés la facilitation de plantations forestières (Dickie et al., 2010) ou la constitution d’une ressource alimentaire locale (Dickie et al., 2016).
La démarche engagée par Monteiro et ses collègues (2023) pour établir une première évaluation mondiale de ces impacts a pu s’appuyer sur des travaux antérieurs (“Global Database of Alien Macrofungi“, Monteiro et al. (2020).
Compilation et traitement des données
Cette base de données leur a permis de réaliser une liste générale, pré-identifiant les taxons de macrochampignons présents en dehors de leurs aires de répartition naturelle. Une recherche additionnelle a ensuite été faite pour compiler études, rapports et autres sources d’information disponibles comportant des éléments sur les impacts de ces espèces. Parmi ces sources ont été utilisées des bases de données importantes, mondiales comme le “Global Register of Introduced and Invasive Species” (Pagad et al., 2019) ou européennes telles que DAISIE “Delivering Alien Invasive Species Inventories for Europe” (Hulme et al., 2019) et “European Alien Species Information Network” (Katsanevakis et al., 2019).
Les auteurs indiquent avoir également utilisé divers moteurs de recherche généraux et scientifiques en employant des mots-clés spécifiques aux champignons (y compris des noms scientifiques de certains taxons) et aux dénominations d’impact, ceci dans plusieurs langues (anglais, français, portugais et espagnol). Les listes de références bibliographiques des publications de recherche répertoriées lors de cette analyse ont également été consultées pour en extraire des informations complémentaires. Ils ont enfin vérifié certains enregistrements obtenus sur des sites de science participative tels que iNaturalist ou “Mushroom Observer“. Les données issues de sources non spécialisées ont été recoupées avec les informations de la littérature scientifique et les données finalement incluses dans l’analyse étaient seulement celles concernant les impacts évalués dans les régions d’introduction des espèces.
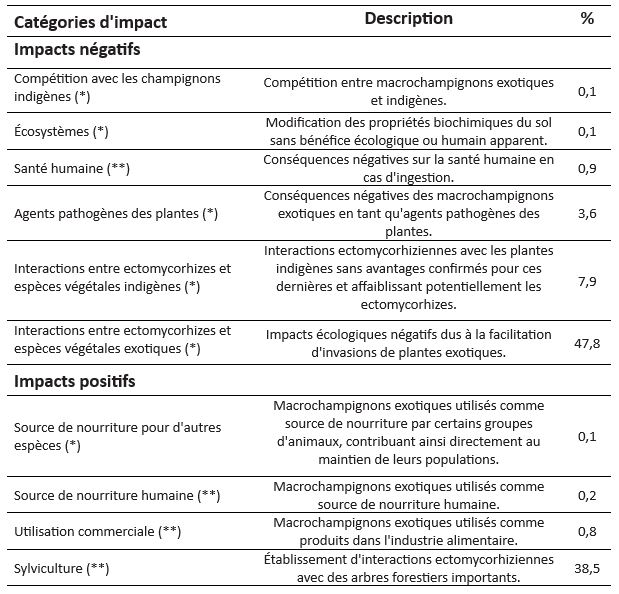
Les impacts des espèces ont été divisés en deux catégories : négatifs et positifs (tableau 1). Les impacts négatifs comportaient les effets néfastes sur les communautés de flore et de faune indigènes et les populations humaines, ou les changements écologiques sans gain apparent, avec différentes sous-catégories telles que problèmes de santé humaine, concurrence avec les champignons indigènes, interactions ectomycorhiziennes diverses, agents pathogènes des plantes et autres changements dans les écosystèmes. Les impacts positifs, à savoir les effets bénéfiques par rapport à la conservation de la nature ou aux intérêts humains (Vimercati et al., 2020), ont également été classés en plusieurs sous-catégories. Cette catégorisation n’est pas exclusive et certains enregistrements pouvaient donc se voir attribuer à la fois des impacts négatifs et positifs distincts.
Afin d’évaluer si le nombre identifié d’impacts était directement lié à la richesse économique de chaque région, ils ont réalisé, par région, des analyses de corrélation entre le nombre d’impacts répertoriés et le PIB (produit intérieur brut) respectif par habitant. Leur hypothèse était que les régions les plus riches pouvaient présenter un plus grand nombre d’impacts enregistrés en raison d’un plus grand nombre d’opportunités d’introduction (Monteiro et al., 2022).
Résultats
Au total, 1 440 enregistrements d’impacts ont été compilés à partir de 246 sources de données. Parmi eux, 869 (60,3 %) ont été identifiés comme des impacts négatifs et 571 (39,7 %) comme des impacts positifs.
La plupart des impacts négatifs répertoriés (tableau 1) sont liés aux interactions que les champignons exotiques forment avec d’autres plantes exotiques (47,8 % des enregistrements), ou avec les plantes indigènes (7,7 %), les maladies des plantes (3,6 %), ou encore l’intoxication humaine après ingestion (1,0 %). Les principaux impacts positifs sont des interactions bénéfiques avec des plantes non indigènes importantes pour la sylviculture (38,5 %), l’exploitation commerciale directe de diverses espèces par l’industrie des conserves et autres industries alimentaires (0,8 %) et utilisation comme source alimentaire directe pour les populations humaines (0,2 % des signalements).
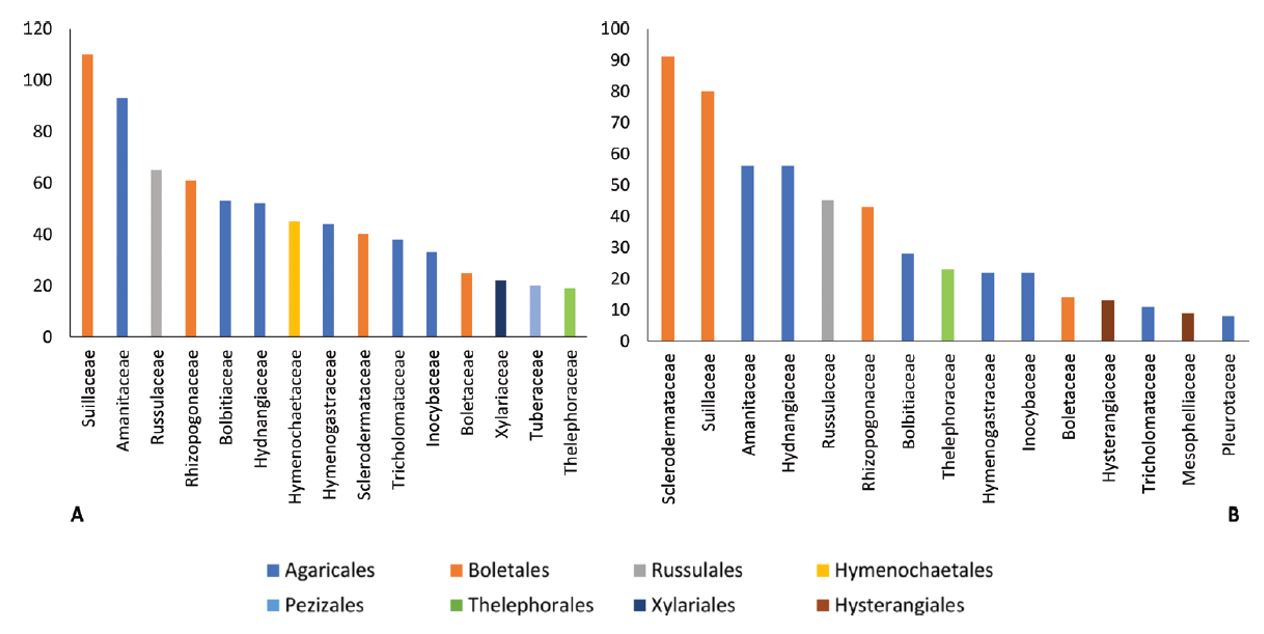
Du point de vue taxonomique, la base d’informations rassemblée ici comporte 374 espèces appartenant à 15 ordres, 50 familles et 85 genres.
La figure 1 présente les nombres d’enregistrements d’impacts des 15 familles les plus fréquemment citées.
Parmi les familles aux enregistrements les plus nombreux dans les deux catégories d’impacts, négatifs et positifs, se trouvent en particulier celles des Suillaceae (anciennement Boletaceae) et des Amanitaceae. Le Bolet jaune (Suillus luteus), de la famille des Suillaceae, est l’espèce présentant la plus grande diversité d’impacts (tableau 2 – ci-dessous). Deux espèces du genre Amanita, A. phalloides (Amanite phalloïde), A. muscaria (Amanite tue-mouches), et le Cèpe de Bordeaux (Boletus edulis) sont également répertoriées dans quatre types d’impacts. Originaires d’Europe (Boletus edulis et A. phalloides) ou considérées comme cosmopolites en raison de l’étendue de leur aire de répartition, ces trois espèces sont présentes en France.

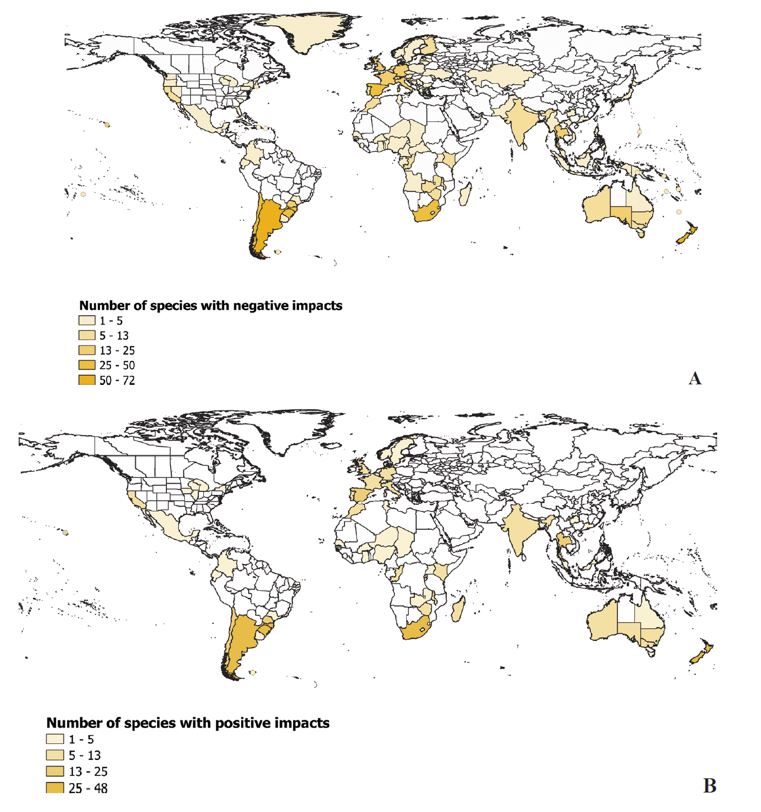
Ainsi que l’indique la figure 2, la répartition mondiale des impacts enregistrés est très variable selon les continents, avec une majorité d’impacts négatifs en Amérique du Sud, en Europe et en Afrique, cependant que les impacts positifs se trouvent surtout en Amérique du Sud, en Afrique et en Océanie. L’Amérique du Nord et l’Asie sont les régions du monde où les impacts ont été les plus faiblement répertoriés.
Discussion et conclusions
Cette étude a donc permis d’identifier un grand nombre et une grande diversité d’impacts négatifs et positifs des macrochampignons exotiques dans de nombreuses régions du monde. Leurs interactions les plus fréquentes concernent cependant les plantes exotiques, avec des effets indirects de facilitation d’invasions d’arbres, dont par exemple les pins (Dickie et al., 2010), les eucalyptus (Santolamazza-Carbone et al., 2019) ou les aulnes et les saules (Bogar et al., 2015). Cette facilitation peut être bénéfique dans un premier temps pour l’établissement d’arbres jugés économiquement importants et, par exemple, des espèces du genre Suillus sont toujours associées aux pins transplantés (Policelli et al., 2019) mais elle peut ensuite contribuer à l’invasion hors des sites de plantations.
Les impacts directs des introductions de macrochampignons sur les communautés végétales indigènes peuvent également être importants par leur persistance dans leur nouvel environnement. Par exemple, des Laccaria bicolor provenant d’Amérique du Nord détectés en Europe dans des plantations de sapin de Douglas dix ans après l’inoculation de semis repiqués ont également colonisé des arbres voisins non inoculés (Selosse & Le Tacon, 1998). De même, des Amanita muscaria ont survécu pendant plus de 36 ans dans des plantations de Pinus radiata en Australie (Sawyer et al., 2001). Ces champignons exotiques établis sur des hôtes indigènes peuvent donc modifier les écosystèmes d’accueil ou les communautés de champignons indigènes (Loo, 2008).
Certaines espèces de macrochampignons peuvent provoquer des maladies des plantes indigènes. Un des exemples cités est celui de Heterobasidion annosum, champignon responsable de la pourriture des racines des conifères, signalée comme envahissante en Asie et en Océanie (Asiegbu et al., 2005).
L’impact le plus signalé sur la santé humaine est l’empoisonnement causé par l’ingestion de l’Amanite phalloïde (Amanita phalloides) (French et al., 2011). Sa fréquence dans les parcs urbains et autres sites augmente le risque d’empoisonnements accidentels (Page & Westcott 2014). La plupart des cas signalés provenaient des États-Unis, en lien avec la répartition de l’espèce dans certains États. D’autres cas d’empoisonnement humain ont également été signalés en Afrique, en Amérique du Sud et en Océanie. Par ailleurs, certaines de ces espèces introduites comme Psilocybe mexicana ou Amanita muscaria peuvent être utilisées comme drogues récréatives… Des impacts positifs cités concernent l’utilisation d’espèces du genre Suillus dans la cuisine ou les conserves, voire la culture de Pleurotus citrinopileatus dans certains États américains comme produit alimentaire commercial (Bruce 2018).
Des impacts négatifs moins connus portent par exemple sur des modifications de fonctionnement des sols suite à l’introduction d’A. phalloides accompagnant des plantations de pins (Pinus radiata) (Chapela et al., 2001) ou encore la concurrence entre les truffes chinoises introduites (dont Tuber indicum) et la truffe indigène moins agressive du Périgord (Tuber melanosporum) dans des plantations en Italie (Murat et al., 2008).
Dans ce premier panorama mondial sur le sujet, les auteurs notent que certaines régions sont clairement sous-représentées, sans pouvoir attester d’une absence réelle d’impacts ou simplement d’un manque de recherches et d’études. Et ils signalent également n’avoir pas identifié de corrélation entre le nombre d’impacts répertoriés et la richesse des territoires.
Selon eux, ces premiers travaux n’ont fait qu’effleurer la problématique (“our work touches only the surface of the impacts being caused by alien macrofungi worldwide“) et, hormis une attention particulière portée aux impacts d’associations symbiotiques de champignons avec des arbres exotiques (voir par exemple, Dickie et al., 2016), de nombreux autres effets de ces interactions avec les taxons indigènes restent probablement sous-estimés. Cela pourrait fortement concerner les impacts sur la biodiversité locale, y compris la souterraine, et en particulier sur la faune (Nuñez & Dickie 2014).
Le recours aux cadres d’évaluation EICAT des impacts des espèces exotiques envahissantes récemment proposés par l’UICN permettant d’évaluer conjointement les impacts négatifs environnementaux (Volery et al., 2020) et socio-économiques (SEICAT, Bacher et al., 2018), et les impacts environnementaux positifs (EICAT+, Vimercati et al., 2022) pourrait faciliter les comparaisons ultérieures avec les autres groupes taxonomiques. Aucun cadre normatif général n’est toutefois actuellement disponible pour prendre en compte les impacts socio-économiques positifs qui, pour ce groupe taxonomique particulier, représentent une part très importante des impacts répertoriés dans les données. Le mode d’évaluation de ces impacts spécifiant leur mécanisme appliqué dans ces travaux pourrait faciliter leur future intégration dans un cadre plus général encore à compléter.
Rédaction : Alain Dutartre, expert indépendant
Relecture : Madeleine Freudenreich (Comité français de l’UICN)
Pour en savoir plus :
Publication principale : Monteiro, M., Capinha, C., Ferreira, M. T., Nuñez, M. A., & Reino, L. (2023). Negative and positive impacts of alien macrofungi: a global scale database. NeoBiota, 85, 23-42. https://doi.org/10.3897/neobiota.85.101770
A propos de champignons : https://fungi.fr/ : base d’informations présentant une détermination simplifiée de plus de mille espèces européennes de champignons. Des photographies des espèces sont accessibles ainsi que des fiches de description. Voir à titre d’exemple les fiches de l’Amanite phalloïde (Amanita phalloides) ou du Cèpe de Bordeaux (Boletus edulis).
Références citées dans l’article :
- Asiegbu FO, Adomas A, Stenlid JA (2005) Conifer root and butt rot caused by Heterobasidion annosum (Fr.) Bref. sl. Molecular Plant Pathology 6(4): 395–409. https://doi.org/10.1111/j.1364-3703.2005.00295.x
- Bacher S, Blackburn TM, Essl F, Genovesi P, Heikkilä J, Jeschke JM, Jones G, Keller R, Kenis M, Kueffer C, Martinou AF, Nentwig W, Pergl J, Pyšek P, Rabitsch W, Richardson DM, Roy HE, Saul W-C, Scalera R, Vilà M, Wilson JRU, Kumschick S (2018) Socio-economic impact classification of alien taxa (SEICAT). Methods in Ecology and Evolution 9(1): 159–168. https://doi.org/10.1111/2041-210X.12844
- Bogar LM, Dickie IA, Kennedy PG (2015) Testing the co‐invasion hypothesis: Ectomycorrhizal fungal communities on Alnus glutinosa and Salix fragilis in New Zealand. Diversity & Distributions 21(3): 268–278. https://doi.org/10.1111/ddi.12304
- Bruce AL (2018) Population genomic insights into the establishment of non-native golden oyster mushrooms (Pleurotus citrinopileatus) in the United States (Doctoral dissertation). University of Wisconsin-La Cruz, USA.
- Capinha C, Essl F, Porto M, Seebens H (2023) The worldwide networks of spread of recorded alien species. Proceedings of the National Academy of Sciences of the United States of America 120(1): e2201911120. https://doi.org/10.1073/pnas.2201911120
- Chapela IH, Osher LJ, Horton TR, Henn MR (2001) Ectomycorrhizal fungi introduced with exotic pine plantations induce soil carbon depletion. Soil Biology & Biochemistry 33(12–13): 1733–1740. https://doi.org/10.1016/S0038-0717(01)00098-0
- Desprez-Loustau ML, Robin C, Buee M, Courtecuisse R, Garbaye J, Suffert F, Sache I, Rizzo DM (2007) The fungal dimension of biological invasions. Trends in Ecology & Evolution 22(9): 472–480. https://doi.org/10.1016/j.tree.2007.04.005
- Desprez-Loustau ML, Courtecuisse R, Robin C, Husson C, Moreau PA, Blancard D, Selosse MA, Lung-Escarmant B, Piou D, Sache I (2010) Species diversity and drivers of spread of alien fungi (sensu lato) in Europe with a particular focus on France. Biological Invasions 12(1): 157–172. https://doi.org/10.1007/s10530-009-9439-y
- Dickie IA, Bolstridge N, Cooper JA, Peltzer DA (2010) Co‐invasion by Pinus and its mycorrhizal fungi. The New Phytologist 187(2): 475–484. https://doi.org/10.1111/j.1469- 8137.2010.03277.x
- Dickie IA, Nuñez MA, Pringle A, Lebel T, Tourtellot SG, Johnston PR (2016) Towards management of invasive ectomycorrhizal fungi. Biological Invasions 18(12): 3383–3395. https://doi.org/10.1007/s10530-016-1243-x
- French LK, Hendrickson RG, Horowitz BZ (2011) Amanita phalloides poisoning. Clinical Toxicology (Philadelphia, PA) 49(2): 128–129. https://doi.org/10.3109/15563650.2011.557663
- Hulme P, Nentwig W, Pyšek P, Vilà M (2019) DAISIE: Delivering alien invasive species inventories for Europe. http://www.europe-aliens.org
- Katsanevakis S, Deriu I, D’Amico F, Nunes A, Sanchez S, Crocetta F, Arianoutsou M, Bazos I, Christopoulou A, Curto G, Delipetrou P, Kokkoris Y, Panov V, Rabitsch W, Roques A, Scalera R, Shirley S, Tricarino E, Vannini A, Zenetos A, Zervou S, Zikos A, Cardoso A (2019) European Alien Species Information Network (EASIN): supporting European policies and scientific research. https://easin.jrc.ec.europa.eu/easin
- Loo JA (2008) Ecological impacts of non-indigenous invasive fungi as forest pathogens. Biological Invasions 11(1): 81–96. https://doi.org/10.1007/s10530-008-9321-3
- Monteiro M, Capinha C, Ferreira MT, Nuñez MA, Reino L (2023) Negative and positive impacts of alien macrofungi: a global scale database. NeoBiota 85: 23–42. https://doi.org/10.3897/neobiota.85.101770
- Monteiro M, Reino L, Schertler A, Essl F, Figueira R, Ferreira MT, Capinha C (2020) A database of the global distribution of alien macrofungi. Biodiversity Data Journal 8: e51459. https://doi.org/10.3897/BDJ.8.e51459
- Monteiro M, Reino L, Ferreira MT, Essl F, Schertler A, Capinha C (2022) Patterns and drivers of the global diversity of non‐native macrofungi. Diversity & Distributions 00(10): 1–14. https://doi.org/10.1111/ddi.13607
- Murat C, Zampieri E, Vizzini A, Bonfante P (2008) Is the Perigord black truffle threatened by an invasive species? We dreaded it and it has happened! The New Phytologist 178(4): 699–702. https://doi.org/10.1111/j.1469-8137.2008.02449.x
- Nuñez MA, Dickie IA (2014) Invasive belowground mutualists of woody plants. Biological Invasions 16(3): 645–661. https://doi.org/10.1007/s10530-013-0612-y
- Pagad S, Genovesi P, Carnevali L, Schigel D, McGeoch M (2019) Global Register of Introduced and Invasive Species – GRIIS. https://doi.org/10.1038/sdata.2017.202
- Page F, Westcott B (2014) High numbers of death cap mushrooms around Canberra. http://www.canberratimes.com.au/act-news/high-numbersofnumbersof-death-capmushrooms- around-canberra-20140429-37fiv.html
- Panzavolta T, Bracalini M, Benigno A, Moricca S (2021) Alien Invasive Pathogens and Pests Harming Trees, Forests, and Plantations: Pathways, Global Consequences and Management. Forests 12(10): 1364. https://doi.org/10.3390/f12101364
- Policelli N, Bruns TD, Vilgalys R, Nuñez MA (2019) Suilloid fungi as global drivers of pine invasions. New Phytologist 222(2): 714–725. https://doi.org/10.1111/nph.15660
- Santolamazza-Carbone S, Durán-Otero M, Calviño-Cancela M (2019) Context dependency, co-introductions, novel mutualisms, and host shifts shaped the ectomycorrhizal fungal communities of the alien tree Eucalyptus globulus. Scientific Reports 9(1): 1–11. https://doi.org/10.1038/s41598-019-42550-x
- Sawyer NA, Chambers SM, Cairney JW (2001) Distribution and persistence of Amanita muscaria genotypes in Australian Pinus radiata plantations. Mycological Research 105(8): 966–970. https://doi.org/10.1016/S0953-7562(08)61953-X
- Selosse MA, Le Tacon F (1998) The land flora: A phototroph-fungus partnership? Trends in Ecology & Evolution 13(1): 15–20. https://doi.org/10.1016/S0169-5347(97)01230-5
- Vellinga EC, Wolfe BE, Pringle A (2009) Global patterns of ectomycorrhizal introductions. New Phytologist 181(4): 960–973. https://doi.org/10.1111/j.1469-8137.2008.02728.x
- Vimercati G, Probert AF, Volery L, Barnardo-Madrid R, Bertolino S, Céspedes V, Essl F, Evans T, Gallardo B, Gallien L, Gonzalez-Moreno P, Grange MC, Hui C, Jeschke JM, Katsanevakis S, Kühn I, Kumschick S, Pergl J, Pyšek P, Rieseberg L, Robinson TB, Saul WC, Sorte CJB, Vilà M, Wilson JRU, Bacher S (2022) The EICAT+ framework enables classification of positive impacts of alien taxa on native biodiversity. PLoS Biology 20(8): e3001729. https://doi.org/10.1371/journal.pbio.3001729
- Volery L, Blackburn TM, Bertolino S, Evans T, Genovesi P, Kumschick S, Roy HE, Smith KG, Bacher S (2020) Improving the Environmental Impact Classification for Alien Taxa (EICAT): A summary of revisions to the framework and guidelines. NeoBiota 62: 547–567. https://doi.org/10.3897/neobiota.62.52723


