Dans la lettre d’information du GT IBMA de décembre 2014, nous faisions état d’un réseau de surveillance « alerte amphibien » mis en place pour détecter la présence de maladies émergentes sur les amphibiens en France, notamment Batrachochytrium salamandrivorans, un champignon pathogène qui avait tout juste été détecté en Belgique et aux Pays-Bas. Une récente étude de l’université de Ghent, en Belgique, alerte sur les graves conséquences de la présence de ce pathogène pour les populations de salamandres européennes.
L’arrivée de B. salamandrivorans en Europe
Batrachochytrium dendrobatidis, le champignon pathogène responsable de la chytridiomycose, une maladie touchant diverses espèces d’amphibiens, a été identifié en Europe à partir de 2009. Sa prévalence varie selon les espèces infectées et la mortalité semble dépendre des différentes souches car elle peut être très différente selon les régions du monde.
En 2013, l’observation de mortalités anormales de populations de Salamandre tachetée (Salamandra salamandra) dans une réserve naturelle aux Pays-Bas, dont les cadavres présentaient des ulcères similaires à ceux causés par B. dendrobatidis, a conduit à l’identification d’une espèce de champignon très proche, Batrachochytrium salamandrivorans. Depuis, ce pathogène s’est rapidement étendu en Europe et a été détecté en Allemagne et en Belgique en 2014.
L’arrivée de ce pathogène en Europe est clairement imputable au commerce international d’amphibiens et à l’absence de mesures de biosécurité (Martel et al., 2014). Il est en effet suspecté d’être arrivé en Europe via des salamandres et des tritons infestés importés d’Asie pour le marché des animaux de compagnie, lesquels auraient développé une résistance au pathogène, contrairement aux espèces européennes (Martel et al., 2014).
Les différences entre B. dendrobatidis et B. salamandrivorans
Appartenant au groupe des chytrides (Chytridiomycota), champignons de zones humides qui consomment de la matière organique en décomposition, les deux espèces présentent un caractère pathogène pour les amphibiens.
L’infection par B. dendrobatidis se manifeste par des changements de comportement (léthargie, manque d’appétit), des troubles neurologiques (perte de réflexes) et des lésions cutanées, allant de modifications de la coloration de la peau à une hyper kératinisation, une mue excessive voire des ulcérations (Dejean et al. 2010). Le taux de mortalité varie selon les espèces et les souches. Certaines espèces comme la Grenouille Taureau (Lithobates catesbeianus) et le Xénope lisse (Xenopus laevis) peuvent être porteurs sains, tandis que chez d’autres espèces le taux de mortalité peut atteindre 100 %. L’infection n’est pas mortelle chez les têtards et leur provoque seulement une dépigmentation des pièces buccales. B. dendrobatidis a ainsi fortement impacté les populations d’amphibiens ces derniers années, avec près de 400 espèces contaminées dans le monde, et de nombreuses extinctions d’espèces lui sont attribuées (Dejean et al. 2010). Plus récemment, Liew et ses collègues (2017) ont montré qu’en conditions de laboratoire, le pathogène pouvait également infecter le Poisson-zèbre (Danio rerio), mettant ainsi en garde sur les impacts que ce pathogène pourrait avoir sur les autres espèces de vertébrés d’eau douce.
L’infection par B. salamandrivorans est assez différente. Il s’avère extrêmement pathogène sur la Salamandre tachetée (Salamandra salamandra) et infecte également, mais dans une moindre mesure, le Triton alpestre (Ichthyosaura alpestris). En revanche, les populations d’anoures, comme l’Alyte accoucheur (Alytes obstetricans) pourtant très sensibles à B. dendrobatidis, n’en souffrent pas et semblent être porteuses saines, contribuant ainsi à sa dispersion. Chez les salamandres, le champignon cause des desquamations de la peau et des ulcérations profondes de l’épiderme, puis une anorexie, une apathie et une ataxie conduisant en quelques semaines à la mort.

Un suivi des populations de salamandre touchées en Belgique
A la suite de la découverte de son arrivée en Belgique en avril 2014, une équipe de l’université de Ghent a suivi des populations de Salamandre tachetée belges pendant deux ans, pour analyser les caractéristiques de l’infection et la dynamique des populations. Les résultats de l’étude viennent de paraître dans Nature (Stegen et al., 2017) et sont très pessimistes : aucune réponse immunitaire n’a été détectée sur les animaux malades. L’arrivée du pathogène entraine ainsi un effondrement massif et rapide des populations de salamandres.
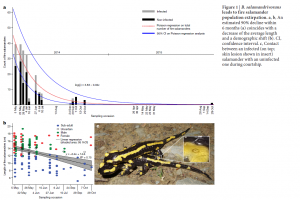
L’exposition à différentes doses et à différents isolats de B. salamandrivorans est létale dans tous les cas. Cette absence de réponse immunitaire ne permet donc pas d’envisager le développement d’un vaccin. Lors de l’étude, des variations de températures ont également été testées, la température optimale du pathogène étant d’environ 15°C, mais bien que les basses températures (4°C) ralentissent l’infection, la mortalité reste la même.
Les salamandres adultes sont les plus exposées à l’infection, en raison de leurs contacts fréquents entre congénères, pour la reproduction notamment, ce qui permet très difficilement à la population de se reconstituer.
Une virulence particulièrement élevée
L’agent pathogène présente une double stratégie de transmission, avec des spores mobiles pouvant survivre quelques jours mais également avec des spores non mobiles enkystées. Ce second type de spores peut survivre plusieurs mois dans l’environnement et adhère facilement, notamment aux écailles des pattes des oiseaux aquatiques, suggérant une importante capacité potentielle de dispersion (Stegen et al., 2017).
Le champignon conserve sa virulence dans l’eau, les sols et sur les anoures et certains urodèles moins sensibles, qui fonctionnent alors comme réservoirs d’infection. La contamination par contact sur le sol peut se produire jusqu’à 48 h après le passage d’un animal infecté.
S’il est possible de guérir les individus en laboratoire, en les maintenant à une température ambiante de 25°C pendant 10 jours pour les espèces qui peuvent le supporter (c’est le cas de la Salamandre tachetée) ou en combinant deux fongicides pour les autres espèces, il n’existe cependant aucune solution pratique à mettre en place pour les individus dans les milieux naturels.

Quelles perspectives et quelles mesures mettre en place ?
Ces caractéristiques combinées laissent craindre que le champignon continue sa progression, rendant extrêmement difficile d’empêcher un déclin massif des populations de salamandres en Europe.
Bien que les données ne concernent pour le moment que la Salamandre tachetée et le Triton alpin, il est fortement probable que d’autres espèces y soient également sensibles, ce qui serait une menace supplémentaire pour les petites populations, en particulier celles des espèces menacées.
La dispersion de la maladie sur le territoire européen pourrait être ralentie en stoppant l’importation d’amphibiens et en veillant à ne pas déplacer des populations, mais aucune solution durable ne semble pour l’instant disponible pour lutter contre le pathogène. De telles mesures préventives nécessitent de mieux identifier les voies d’introduction de B. salamandrivorans, outre celles connues de l’aquariophilie et du commerce direct des amphibiens, qui pourraient propager les spores résistants du champignon (empoissonnements, risques liés aux pratiques des loisirs aquatiques (canoé, pêche), etc.).
Des mesures préventives ont cependant été rapidement prises aux Etats-Unis dès 2016, où B. salamandrivorans ne semble pas encore présent. Une réglementation interdit dorénavant l’importation de 201 espèces de salamandres sur le territoire (Lacey act, 2016). Le Canada a mis en place des mesures similaires en 2017 (Wild Animal and Plant Protection and Regulation of International and Interprovincial Trade Act, 2017) et a développé des fiches informatives accompagnées de protocoles de biosécurité en français et en anglais, à destination des scientifiques, des gestionnaires d’espaces naturels et des animaleries et des particuliers.

Pour les zones où le pathogène est d’ores et déjà détecté, son éradication semble complexe à mettre en œuvre. Dans la conclusion de leur étude en Belgique, Stegens et al. (2017), insistent sur la nécessité de développer un système de surveillance et de détection précoce de la maladie à l’échelle pan-européenne, ainsi que sur la mise en place de plans d’urgence pour préserver les espèces européennes de salamandres. Selon eux, en dehors des actions de surveillance et de prévention, une coexistence durable du pathogène et de ses hôtes serait à rechercher à l’aide de stratégies d’intervention qui augmenteraient de manière permanente la résistance des espèces sensibles. Cependant, le risque d’une extinction massive d’urodèles en Europe ne peut être exclu.
En savoir plus :
- Signalez toute observation d’amphibien infecté sur le site « alerte-amphibien.fr ».
Bibliographie :
Stokstad E. 2017. A deadly salamander disease just got a lot scarier. Science Mag. DOI: 10.1126


