Rappels
Cette plante aquatique a été observée à partir de 2008 dans ces plans d’eau lorrains proches de Sarrebourg gérés par Voies Navigables de France pour l’alimentation en eau du réseau de canaux de la région. Sa colonisation croissante, causant des nuisances pour les usagers de ces plans d’eau, a amené en 2015 à la mise en place d’une étude destinée à évaluer les caractéristiques et l’ampleur de la colonisation, et les moyens de la gérer.
Les résultats de cette étude ont amené en octobre 2016 la diffusion d’un premier article présentant des informations sur les sites, la plante, les nuisances qu’elle peut causer et les moyens de la gérer : L’aloès d’eau, une espèce envahissante qui s’éveille en Lorraine ? ; Mais quelle est donc cette stratiotes qui prolifère ?
Les prospections de terrain de 2016 ayant montré une forte disparité de l’évolution de cette colonisation, stable ou presque sur deux sites secondaires, disparue sur le plan d’eau fortement colonisé l’année précédente, un deuxième rapport a été élaboré par le même bureau d’études ECOLOR, faisant état de ce rapide changement de situation et comportant des éléments de cadrage et de propositions de gestion de l’espèce dans les sites toujours colonisés. L’ensemble de ces informations a conduit à la mise en ligne d’un deuxième article en mars 2017 : Aloès d’eau (Stratiotes aloides) en Lorraine : un éveil partiel et temporaire ?
Et depuis ?
Compte-tenu des acquis d’informations fournis par les études antérieures montrant une dynamique rapide des populations de l’espèce selon les sites et des nécessités d’évaluation des interventions de gestion, des suivis confiés au bureau d’étude ECOLOR ont été poursuivis en 2017, puis en 2019, 2020 et 2021. Des investigations ont été réalisées en 2022 par les services de Voies navigables de France.
Par ailleurs, le développement tout à fait exceptionnel de cette espèce dans ces sites nous a conduits à rechercher des informations complémentaires sur Internet et auprès de différents chercheurs européens travaillant sur les questions de gestion des plantes aquatiques, ce qui a permis de rassembler diverses publications sur l’écologie de l’espèce, principalement dans plusieurs pays européens.
Le présent article a donc pour objectif de faire un bilan des connaissances sur l’espèce et son écologie, pouvant améliorer la compréhension du fonctionnement écologique de ces plans d’eau et ainsi faciliter la gestion à y maintenir pour espérer mieux satisfaire l’ensemble des objectifs de conservation et d’utilisation les concernant. Un second article vous sera proposé ultérieurement pour présenter les interventions de régulation de l’espèce mises en place, examiner l’évolution des sites et les perspectives possibles de cette colonisation.
Stratiotes aloides (aloès d’eau) : quelle est donc cette espèce ?

L’article de 2016 présentait des informations sur la morphologie de cette espèce, en particulier celle des feuilles émergées en rosette très reconnaissables et facilitant leur identification car raides et épineuses, pouvant atteindre 4 cm de largeur et 40 cm de longueur. Cette morphologie explique d’ailleurs les noms qui lui sont attribués en français, mais aussi en anglais (“water soldier“, ce qui se passe de traduction) ou en allemand (“Krebsschere“, pince de crabe ?).
Une écologie très particulière
De même, son écologie tout à fait particulière était rappelée : cette plante immergée en hiver et au printemps vient émerger durant l’été si les profondeurs des eaux ne sont pas trop importantes. En situation immergée, elle présente des feuilles également en rosettes mais minces (1 cm de largeur) et flasques et pouvant atteindre 60 cm (rarement 110 cm selon Cook & Urmi-König, 1983).
En situation émergée, elle peut fleurir en produisant des fleurs blanches à 3 pétales de 3 à 4 cm de diamètre situées sur des pédoncules pouvant dépasser 30 cm pour les fleurs mâles et atteindre 20 cm pour les fleurs femelles mais émergeant de moins de 10 cm.
Dans des conditions de profondeurs d’eau favorables, la plante peut émerger en fin de printemps, ainsi que le montre le diagramme de Renman (1989) ci-dessous (Figure 1) pour une population de la plante étudiée dans le lac suédois de Sör-Tuvträsk, puis fleurir et produire des turions avant d’être de nouveau immergée en fin d’automne.

C’est bien cette présence temporaire en surface des eaux, à la période où les usages humains des plans d’eau sont les plus importants, qui a généré les nuisances dans les deux plans d’eau mosellans de Gondrexange et du Stock puis le suivi de la situation et la mise en place des interventions de gestions. Dans les biotopes favorables (c’est-à-dire : absence de courant, pleine lumière, faible profondeur, réchauffement estival des eaux), la plante peut en effet se développer en herbiers très denses colonisant toute la surface, réduisant la lumière dans la masse d’eau et empêchant le déplacement des embarcations.
Cependant, dans la même publication, Renman (1989) présentait des résultats de suivi sur une autre population de S. aloides (Figure 2) dans un plan d’eau adjacent à un cours d’eau (“lagoon” Abborravan). Ce plan d’eau subit de très fortes variations de niveau des eaux durant l’année, avec le maintien de plus de 2 m d’eau jusqu’en juillet, réduisant le développement des plantes et empêchant ainsi leur émergence.
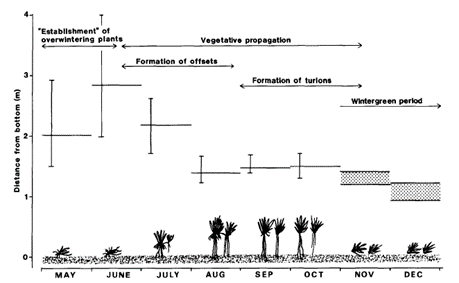
Les niveaux des eaux et leurs variations au cours de l’année peuvent donc avoir des impacts directs, soit positifs, soit négatifs sur le développement des plantes, leur production de biomasse et leur capacité d’émergence.
Enfin, S. aloides peut temporairement survivre dans les eaux peu profondes en voie d’assec. Les plantes émergées sont généralement plus petites et seules subsistent les feuilles supérieures lignifiées. Une intensification de la reproduction végétative peut alors se produire conduisant à la formation de turions (5-7 individus par rosette selon Efremov & Sviridenko, 2008).
Reproduction
Les plantes de Stratiotes aloides sont généralement dioïques (c’est-à-dire que les organes mâles et les organes femelles sont portés par des individus séparés), plus rarement monoïques. Par exemple, en Belgique, les populations monoïques prédominent, alors que dans le bassin du Danube et dans l’Oural, les populations sont plus souvent dioïques (Preston & Croft, 1997 ; Demyanova, 2012).
Dans leur publication de synthèse sur l’écologie de l’espèce, Efremov et al. (2019) présentent des données se référant à diverses régions, depuis l’Europe de l’Ouest jusqu’en Sibérie de l’ouest, sur la fréquence de floraison des plantes (de 27 à 90 %), de répartition de plantes mâles et femelles (rapports pouvant aller de 1,1 pour 1 à 100 % de femelles ou de mâles) montrant une très grande variabilité. Cette distribution spatiale inégale de populations de plantes avec de telles différenciations sexuelles peut limiter la capacité de reproduction sexuelle de l’espèce (Smolders et al., 1995a).
Ils indiquent également que le taux de plantes submergées augmente vers le nord et que de nombreuses populations nordiques sont même entièrement représentées par des plantes de cette forme ne se reproduisant que de manière végétative (Erixon, 1979a).
Le fruit qui peut être produit après fécondation d’une fleur femelle est une capsule en forme de baie pouvant contenir jusqu’à 24 graines. Parmi les quelques espèces de diptères pollinisatrices de S. aloides, Katzenberger & Zacharias (2015) ont récemment identifié une espèce de la famille des Ephydridae, Hydrellia tarsata, dont les larves mineuses se nourrissent de la plante.
Dans leur synthèse sur le genre, Cook & Urmi-König (1983) rappelaient la rareté des graines, due en particulier à la présence nécessaire des deux sexes de la plante dans le même site. Leur germination est très variable et leur dispersion se fait par flottaison sur des distances variables selon les conditions de vents, de courant, etc. L’émergence des plantules ne semble pas limitée par la lumière ou la vernalisation (c’est dire la période de froid nécessaire pour enclencher la germination) (Smolders et al., 1995). Une longue période d’émergence de ces plantules (jusqu’à 12-15 mois) est un mécanisme assurant la survie pendant les fluctuations du niveau d’eau et l’adaptation aux conditions anaérobies du sédiment.
Comme de nombreuses plantes aquatiques, S. aloides se développe principalement par reproduction végétative, en développant des bourgeons (ou turions) ou des pousses latérales. Cette croissance végétative peut être rapide, permettant aux plantes d’occuper de grandes superficies sur de courtes périodes de temps. Au début de la phase de croissance végétative, ce sont principalement des pousses latérales qui sont formées alors qu’en automne la formation de turions augmente de manière significative. Un tableau d’Efremov et al. (2019) indique par exemple une production variable de une à plus de cinq pousses latérales par pied émergé en été et une à près de deux par pied immergé en automne avec des nombres de turions pouvant dépasser dix.

Ces turions sont des formes spécialisées pouvant assurer la survie de la plante durant les périodes défavorables (gel de la colonne d’eau, sécheresse, etc.). En automne, ils coulent au fond du plan d’eau où ils hivernent. Au printemps, ils germent puis remontent à la surface de l’eau où ils peuvent alors être dispersés sur de longues distance car ils semblent pouvoir conserver leur capacité de flottaison pendant plus de 6 mois (Sarneel, 2013). Ce type de diaspore permet un développement maximal et rapide dès que les conditions environnementales deviennent favorables.
Contrairement aux turions, les pousses latérales ne peuvent être dispersées que sur de plus courtes distances.
La croissance en hiver de S. aloides confère à cette plante vivace certains avantages compétitifs par rapport aux autres macrophytes, comme un renouvellement végétatif rapide au printemps, la capacité à former des peuplements très denses ou à se développer sous la glace (Renman, 1989 ; Efremov et Sviridenko, 2008). Les formes immergées à la reproduction seulement végétative peuvent se développer dans des eaux plus pauvres en nutriments que les émergées car plus résistantes aux conditions environnementales. Les deux formes peuvent produire des nombres assez similaires de turions (Figure 3) et de pousses latérales mais les formes émergées développent des pousses latérales beaucoup plus développées (Toma, 2006).
Communautés végétales
Ainsi que l’indiquent Efremov et al. (2019), les communautés végétales de S. aloides en Eurasie ont fait l’objet de nombreux travaux de recherche (voir par exemple Chytrý, 2011 ; Efremov & Sviridenko, 2011 ; Skwierawski & Skwierawska, 2013 ; Yamalov et al., 2014).

Au total 23 associations ont été décrites. Ces communautés comprennent au moins 134 espèces de plantes aquatiques dont 110 espèces de plantes vasculaires, 19 espèces de macroalgues et 5 espèces de mousses et d’hépatiques. Les espèces les plus présentes dans ces communautés sont en particulier le cornifle (Ceratophyllum demersum), la morène (Hydrocharis morsus-ranae), des lentilles d’eau comme Lemna trisulca ou Spirodela polyrhiza ou l’utriculaire Utricularia vulgaris.
De nombreuses autres espèces aquatiques des eaux stagnantes ou peu courantes peuvent également en faire partie, des immergées comme des espèces de potamots, de myriophylles ou de nénuphars, ou des émergées comme le Plantain d’eau (Alisma plantago-aquatica) ou d’autres hélophytes du bord des eaux. Les communautés étudiées au Canada (Snyder et al., 2016) comportent une trentaine d’espèces.
Elle se rencontrent toutes dans des eaux stagnantes ou à faible courant, mésotrophes à eutrophes (teneurs en nutriments moyennes à élevées) où S. aloides est capable de développer des peuplements denses voire monospécifiques pouvant occuper des superficies de plusieurs hectares dans les biotopes les plus favorables. Elles sont très fréquentes dans les lacs de plaine d’inondation, mais aussi dans les lacs de bassin, les bras de rivière ou les réseaux de chenaux en zones humides.
Conditions de développement et production de biomasse
Espèce tempérée (Nielsen & Borum, 2008 ; Forbes, 2000), S. aloides est rarement présente à des altitudes supérieures à 300-500 m. Elle est présente dans des conditions de pleine lumière à des profondeurs de 0,5 à 2,5 m, la profondeur optimale étant de 0,5 à 1,5 m (Efremov et al., 2019). Dans des milieux de profondeurs plus importantes (2,5 à 5,0 m), seules se maintiennent des formes immergées. Des vitesses d’écoulement des eaux supérieures à 0,2 m/s peuvent empêcher son développement tout comme des fluctuations trop importantes des niveaux des eaux (Cook & Urmi-König, 1983 ; Smolders et al., 2003) ou une turbidité élevée.
Malgré le fait que l’espèce puisse s’installer dans des eaux eutrophes, des concentrations excessives de nutriments peuvent entraîner des régressions des populations (Harpenslager et al., 2016). Stratiotes aloides peut présenter un taux de croissance très élevé et accumuler des biomasses relativement importantes mais très variables selon les sites.
Par exemple, des mesures de productivité de De Geus-Kruyt & Segal (1973), obtenues aux Pays-Bas, donnaient des valeurs en poids sec de 112 à 210 kg/ha/jour, jusqu’à un maximum de 460 kg/ha/jour, pour des valeurs de biomasse pouvant atteindre 6300 kg/ha. Les travaux d’Erixon (1979b) en Suède indiquaient des biomasses sèches de 290 kg/ha et 756 kg/ha respectivement en juin et septembre. Et ceux de Strzałek & Koperski (2009) sur un plan d’eau dans le centre de la Pologne, citaient des valeurs de biomasse de moins de 500 g/m² au printemps et un maximum en août de 1450 g/m², soit 14 500 kg/ha.
Répartition

Selon l’INPN, cette espèce est considérée en métropole comme “indigène ou indéterminée” (MNHN et OFB, 2023). L’espèce était présente en Europe au Pléistocène puisque des fossiles ont été identifiés dans des sites en Angleterre, Belgique, Pays-Bas, Danemark, Allemagne, Suisse, Italie, Tchécoslovaquie et dans la Russie et l’ouest de la Sibérie (Cook & Urmi-König, 1983). Sa répartition actuelle (Figure 5), ainsi que la présente la carte dans la publication de Efremov et al. (2019), doit être partiellement liée à son intérêt horticole comme espèce largement cultivée dans les jardins botaniques et jardins privés depuis le début du XVIIe siècle, et à ses achats toujours possibles comme plante de bassin. Cette dispersion humaine rend difficile la détermination d’une aire originelle de répartition.
Sa relative rareté en métropole a conduit à ce qu’elle soit protégée dans plusieurs régions (Bourgogne, Champagne-Ardenne, Franche-Comté, Haute-Normandie, Île-de-France, Nord-Pas-de-Calais, Poitou-Charentes, Rhône-Alpes). Elle est en revanche inscrite sur la liste des organismes nuisibles dont l’introduction est interdite en Nouvelle-Calédonie (Article 1).
Elle est assez répandue en Europe avec de nombreuses populations dont certaines assez stables, avec une reproduction sexuelle occasionnelle, mais elle est toutefois notée comme disparue en Espagne, en Italie, vulnérable en Croatie et en Suisse, quasi menacée en Hongrie et en voie de disparition en République Tchèque (Efremov et al., 2019).
Plante ornementale vendue en Amérique du Nord, sa première implantation observée à partir de 2008 en milieu naturel est une importante colonisation dans la rivière Trent dans l’État d’Ontario au Canada, étendue dans un premier temps à des sites proches (Snyder et al., 2016), en progression depuis apparemment continue à d’autres milieux. Elle est également présente au Québec dans deux sites (Laplante & Proteau, 2020). Une fiche de présentation de l’espèce est disponible en français sur le site Sentinelle du Ministère de l’environnement québécois.
Selon le réseau international d’information sur la biodiversité, le GBIF, l’espèce est considérée comme introduite en Australie, Irlande, Norvège et Suisse. Elle est également considérée comme présentant un potentiel d’invasion en Nouvelle Zélande (Champion et Clayton, 2000).
Régressions
Depuis plusieurs décennies, des régressions de ses populations ont été observées dans de nombreux sites depuis l’Europe centrale jusqu’aux Pays-Bas. Selon Efremov et al. (2019), l’espèce serait ainsi en danger en Serbie, Croatie, Bosnie-Herzégovine, Suisse, République tchèque, Belgique, Bulgarie, Moldavie, Hongrie, Ukraine et en Allemagne. Dans la partie asiatique de son aire de répartition, la situation ne semble pas préoccupante mais dans les régions d’agriculture intensive elle est considérée comme quasi menacée.
Ces régressions ont conduit au développement de recherches destinées à en définir les causes, telles que disparitions des habitats favorables, modifications du fonctionnement hydrologique de ces habitats ou dégradation de la qualité des eaux. Ainsi, les aménagements et les évolutions d’utilisation des zones agricoles ont conduit à la disparition de nombreux habitats favorables à l’espèce.
En ce qui concerne la qualité des eaux, l’eutrophisation a joué un rôle dans le processus mais d’autres éléments ont également pu intervenir : par exemple, dans les recherches menées aux Pays-Bas, Smolders et al. (2003) indiquent que l’évolution des teneurs en sulfate des eaux liée aux modifications récentes de fonctionnement hydrologique des sites serait la variable principale du déclin de S. aloides. De même, les évolutions observées durant environ 40 ans dans un paysage agricole proche de Poznan en Pologne montrent de fortes modifications des communautés végétales, dont la totale disparition de certaines d’entre elles, y compris celle comportant S. aloides, attribuée aux augmentations de teneurs des eaux en ammonium et en sulfures causés par l’intensification de la gestion des prairies (Gołdyn & Arczyńska-Chudy, 2009).
Stratiotes aloides : une ressource pour la biodiversité et certaines espèces de faune ?
Comme la plupart des macrophytes, S. aloides est une source potentielle de nourriture pour diverses espèces de faune aquatique ou inféodée aux milieux aquatiques : mammifères comme le Ragondin ou le Rat musqué ou encore le Castor d’Europe (Sviridenko et al., 1987), oiseaux aquatiques (canards, cygnes et foulques) ou encore diverses espèces de mollusques, de coléoptères, diptères ou lépidoptères, mais aucun invertébré ne semble se nourrir spécifiquement de la plante (Cook & Urmi-König 1983).
De plus, par sa taille et sa présence continue dans les milieux, elle peut constituer un abri pour la petite faune d’invertébrés (insectes, micro-crustacés, etc.) contre la prédation des poissons (Rantala et al., 2004 ; Strzałek & Koperski, 2009).
Du point de vue de la conservation de la biodiversité, S. aloides est d’ailleurs souvent considérée comme un élément important des milieux que l’espèce colonise par ses rôles de substrat et de refuge qu’elle fournit aux communautés fauniques (Efremov & Sviridenko, 2008). Ses herbiers émergés sont en particulier des lieux de nidification privilégiés de la Guifette noire (Chlidonias niger), aux Pays-Bas comme dans d’autres parties de l’Europe du Nord. La nette régression de S. aloides dans de nombreux site a contribué aux Pays-Bas au déclin de plus de 90 % des populations de cet oiseau migrateur, rare et protégé (van der Winden, 2000 ; Beintema et al., 2010).
Les populations de S. aloides jouent également un rôle important pour certaines espèces de libellules protégées, comme par exemple Aeshna viridis, l’Æschne verte, présente des Pays-Bas à l’ouest de la Sibérie. Les œufs déposés par la femelle de cette libellule dans la partie submergée des feuilles de la plante émergée sont ensuite transportés sous l’eau lorsque la plante tombe au fond à l’automne et les larves peuvent ensuite rester sur la plante pendant leur développement durant deux ou trois ans. En Allemagne la régression des populations de S. aloides a constitué une menace pour la survie de cette libellule (Haacks & Peschel, 2007).
C’est pourquoi la conservation de S. aloides est maintenant considérée comme cruciale pour la survie de cet odonate menacé dans certaines parties de l’Europe (Suhonen et al., 2013) et que, par exemple, un vaste programme de mesures de gestion de l’espèce a été entrepris dans ce but dans une zone Natura 2000 de la région de Brème en Allemagne (Jordan et al., 2010 ; Kunze et al., 2012).

D’autres démarches de conservation de cette espèce dans le contexte européen peuvent être entreprises. Elle était abondante avec des populations essentiellement femelles dans les zones humides de la plaine orientale du Pô en Italie jusqu’au début du vingtième siècle. Attribuée aux conséquences de l’agriculture intensive et de l’élevage, sa régression a conduit jusqu’à sa disparition en milieu naturel. Des plantes de cette population italienne ont récemment été redécouvertes en dehors du milieu naturel et sont actuellement conservées dans trois collections privées ex situ.
Cette découverte permettrait donc de réintroduire la population indigène dans la région. De tels rétablissements de populations d’espèces éteintes dans la nature à partir de stocks d’individus conservés ex situ est une pratique qui se développe dans le monde entier (Orsenigo et al., 2016).
Dans leur publication, Orsenigo et ses collègues rappellent aussi les intérêts écologiques de S. aloides pour la conservation et la protection d’espèces telles que la libellule Aeshna viridis (Suhonen et al., 2013) ou la Guifette noire Chlidonias niger (Beintema et al., 2010). Selon eux, une réintroduction de cette espèce en Italie permettrait de contribuer à l’élaboration d’une stratégie de conservation intégrée pour cette espèce dans l’ensemble de son aire de répartition.
Stratiotes aloides, une espèce envahissante ?
Dans le précédent article, nous avions signalé une intervention d’extraction de la plante dans la mare Bouttieux située dans la forêt de Brotonne en Normandie car sa colonisation pouvant couvrir cette mare de 19 ha menaçait les communautés de plantes rares et protégées de ce site ZNIEFF.
Hormis une nouvelle recherche de publications sur l’espèce, les contacts pris auprès de différents chercheurs européens montraient que quelques interventions locales d’enlèvement mécanique de certaines populations avaient eu lieu aux Pays-Bas et en Grande-Bretagne et que des développements de certaines populations étaient notés en Irlande et en Grande-Bretagne. Par exemple, observée depuis 2006 en Irlande dans des sites très localisés (Minchin & Boelens, 2011), S. aloides montre, dans un de ces sites situé dans le Lough Derg, au Sud-Est de Galway, une extension progressive qui, cependant, n’a pour le moment pas été jugée comme nécessitant une intervention (Minchin et al., 2021).
En revanche, la colonisation observée depuis 2008 dans la rivière Trent, État d’Ontario au Canada, a très rapidement fait l’objet d’interventions de gestion (Snyder et al., 2016). L’espèce s’est étendue depuis dans le cours d’eau en quelques années et en 2015 elle a été observée dans un autre site avec des développements monospécifiques aux superficies pouvant dépasser 20 ha (Weissflog & Sager, 2016).
Comme il s’agissait d’une première implantation importante de l’espèce au Canada, une étude a été lancée pour évaluer les risques de cette colonisation, liés en particulier à ses capacités reproductives dans le contexte nord-américain, et mesurer sa production de biomasse et de propagules de dispersion (turions et pousses). L’étude a porté sur les deux formes de la plante (émergée et immergée). Les biomasses mesurées semblent relativement importantes avec des valeurs respectives de 13,9 kg (forme émergée) et 6,0 kg (forme immergée), exprimées en matière fraîche par m². La viabilité des turions et leur durée de survie dans les sédiments ont également été examinées : il a été constaté qu’ils ne subsistaient pas plus de 8 à 9 mois et qu’une période d’été pendant laquelle aucun ne se trouvait dans les sédiments comme forme de résistance pouvait peut-être améliorer l’efficacité des interventions de régulation des populations (Weissflog & Sager, 2016).
Le recours aux herbicides en milieu aquatique étant autorisé au Canada, des tests ont été réalisés en laboratoire au Centre pour les plantes aquatiques et envahissantes de l’Université de Floride sur des plants de S. aloides collectés en Ontario. Ils ont montré une efficacité du Diquat (un herbicide de la famille des bipyridines encore largement utilisé dans le monde pour des applications en milieux aquatiques, mais interdit en France) pour les concentrations testées les plus élevées et une durée de contact d’au moins 16 heures. Des applications expérimentales en milieu naturel ont ensuite été mises en œuvre dans la rivière Trent en 2009 et 2010.
Un rapport cité par Snyder et al. (2016) indique qu’elles ont été efficaces pour réduire les colonisations denses dans les baies peu profondes présentant peu ou pas d’écoulement mais que cette efficacité était réduite dans les eaux plus profondes, plus courantes et turbides. La conclusion du rapport était que la mortalité totale des plantes ne pouvait être généralement atteinte et qu’il n’était donc pas certain que l’application de Diquat sur le terrain parvienne à freiner la propagation de la plante. Fin 2015, une application plus étendue de cet herbicide a été entreprise dans la rivière Trent mais les résultats n’étaient pas encore évalués lors de la publication de Snyder et al. (2016).
Il semblerait que des interventions d’arrachage manuel par des volontaires aient également été réalisées mais non pas non plus donné tous les résultats attendus.
Un plan de gestion intégrée de l’espèce élaboré par le ministère des Richesses naturelles et des Forêts de l’Ontario a été publié en septembre 2020. Il a pour objectif d’éradiquer ou au moins contenir les populations présentes par des actions coordonnées de prévention d’introduction et de propagation, de détection précoce et réponse rapide, et d’éradication. Le document rassemble des informations sur l’espèce, les contextes règlementaires de la gestion, etc., et précise les personnes autorisées pour intervenir, les actions autorisées (possession et transport de la plante dans le cadre de la prévention, de la surveillance, du contrôle et de l’élimination la concernant ; dépôt en dehors de l’eau pour éliminer les plantes ou les parties de plantes enlevées) et les conditions pratiques de ces interventions, dont une référence directe aux nécessités de bonnes pratiques concernant le nettoyage des embarcations.
Les applications d’herbicides ont été poursuivies puisque des informations et des cartes de répartition de la plante dans quatre sites colonisés sont disponibles en ligne : en signalant pour 2020 des réductions de superficies de 25 à 68 % par rapport à la situation de 2019, les commentaires constatent que le traitement herbicide de 2019 a été un succès : “the 2019 herbicide treatment was a success“.
Stratiotes aloides est donc effectivement considérée comme une espèce exotique envahissante en Ontario et au Canada et divers documents d’information sont disponibles pour son identification et les bonnes pratiques à appliquer pour sa gestion :
– http://www.invadingspecies.com/invaders/aquatic-plants/water-soldier-2/
– https://www.invasivespeciescentre.ca/
De plus, son extension à partir des premiers sites d’installation préoccupe maintenant de plus vastes territoires situés sur le bassin versant du lac Ontario : “Water Soldier has been Found in the Bay of Quinte. Now, we have a big problem” https://www.bqrap.ca/the-science/water-soldier/ (consultation mars 2023).
Pour en savoir plus :
- L’aloès d’eau, une espèce envahissante qui s’éveille en Lorraine ?
- Mais quelle est donc cette stratiotes qui prolifère ?
- Un peu d’étymologie pour en savoir plus sur le terme “Stratiotes”
- Aloès d’eau (Stratiotes aloides) en Lorraine : un éveil partiel et temporaire ?
Références bibliographiques citées
- Beintema, A.J., van der Winden, J., Baarspul, T., de Krijger, J.P, van Oers, K., and Keller, M. 2010. Black Terns Chlidonias niger and their dietary problems in Dutch wetlands. Ardea, 98: 365–372.
- Champion, P.D., Clayton, J.S., 2000. Border Control for Potential Aquatic Weeds. Stage 1, Weed Risk Mode.141. Department of Conservation, Wellington.
- Chytrý, M. (Ed.), 2011. Vegetace České republiky. Academia, Praha. 3, Vodní a mokřadní vegetace. Academia.
- Cook, C.D.K., Urmi-König, K., 1983. A revision of the genus Stratiotes (Hydrocharitaceae). Aquat. Bot. 16, 213–249.
- De Geus-Kruyt, M. and Segal, S., 1973. Notes on the productivity of Stratiotes aloides in two lakes in The Netherlands. Pol. Arch. Hydrobiol., 20: 195–205.
- Demyanova, E.I., 2012. On the sexual structure of populations of some dioecious plants. Bot. J. St. Petersburg. 97 (9), 1163–1174.
- Efremov, A.N., Sviridenko, B.F., 2008. The ecobiomorph of water soldier stratiotes aloides L. (Hydrocharitaceae) in the west Siberian part of its range. Inland Wat. Biol. 1 (3), 225–230.
- Efremov, A.N., Sviridenko, B.F., 2011. Coenocomplex of Stratiotes aloides L. (Hydrocharitaceae) in the South Part of the West Siberian Plain. Bul. St Petersburg Univ. Biology, pp. 28–38 2.
- Efremov, A. N.; Sviridenko, B.F.; Toma, C.; Mesterházy, A.; Murashko, Y.A. 2019. Ecology of Stratiotes aloides L. (Hydrocharitaceae) in Eurasia. Flora, 253, 116–126.
- Erixon, G., 1979a. Environment and aquatic vegetation of a riverside lagoon in northern Sweden. Aquat. Bot. 6, 95–109.
- Erixon, G. 1979b. Population ecology of a Stratiotes aloides L. stand in a riverside lagoon in N. Sweden. Hydrobiologia, 67: 215–221
- Forbes, R.S., 2000. Assessing the Status of Stratiotes aloides L. (Water-soldier) in Co. Fermanagh, Northern Ireland (v. C. H33). Watsonia 23, 179–196.
- Gołdyn H., Arczyńska-Chudy E., 2009. Response of aquatic vegetation to eutrophication processes in agricultural landscape exemplified by the Gen. D. Chlapowski Landscape Park. Teka Kom. Ochr. Kszt. Środ. Przyr. – OL PAN, 6, 71–78
- Haacks, M., and Peschel, R. 2007. Die rezente Verbreitung von Aeshna viridis und Leucorrhinia pectoralis in Schleswig-Holstein – Ergebnisse einer vierjährigen Untersuchung (Odonata: Aeshnidae, Libellulidae). Libellula, 26: 41–57.
- Harpenslager, S.F., Lamers, L.P.M., Heide, Tvander, Roelofs, J.G.M., Smolders, A.J.P., 2016. Harnessing facilitation: why successful re-introduction of Stratiotes aloides requires high densities under high nitrogen loading. Biol. Conserv. 195, 17–23
- Jordan R. et al., 2010. Erprobung von Managementmaßnahmen in Bremen zum Erhalt der Krebsschere als Leitart für die ökologisch wertvollen Graben-Grünland-Gebiete der Kulturlandschaft Nordwestdeutschlands. Endbericht 2010, Teil1, 246 pp
- Katanskaya, V.M., 1970. Vegetation of Steppe Lakes of Northern Kazakhstan and Adjacent Territories, in: Lake of the Semi-arid Zone of the USSR. Leningrad. pp. 92–135.
- Katzenberger, J., Zacharias, D., 2015. Mutualism of Stratiotes aloides L. (Hydrocharitaceae) and Hydrellia tarata Haliday (Diptera: Ephedridae): tritrophic interaction of macrohyte, leaf-mining dipterian pollinator and parasitoid Braconidae. J. Pollin. Ecol. 15 (4), 23–29.
- Kunze, K., Jordan, R., Kesel, R., Kundel, W., Nagler, A., Schirmerm, M., and Zacharias, D. 2012. Erprobung von Managementmaßnahmen zum Erhalt der Krebsschere (Stratiotes aloides) als Leitart für die ökologisch wertvollen Graben-Grünland-Gebiete der Kulturlandschaft Nordwestdeutschlands. Nat Landsch. 87: 362–369.
- Laplante, F. & Proteau, V. 2020. Implantation et propagation du stratiote faux-aloès (Stratiotes aloides) dans un étang artificiel en Estrie. Le Naturaliste canadien, 144 (1), 60–62.
- Minchin D., 2007. A checklist of alien and cryptogenic aquatic species in Ireland. Aquatic Invasions Volume 2, Issue 4: 341-366
- Minchin, D. & Boelens, R. 2011. The distribution and expansion of ornamental plants on the Shannon Navigation. Biology and Environment 111B: 195-204
- Minchin D., Boelens R., Higgins D. 2021. Expansion of a localised population of the introduced Stratiotes aloides (Hydrocharitaceae) in Lough Derg, Ireland. British & Irish Botany 3(4): 455-468
- Mulderij G., Smolders A. J. P., Donk E., 2006. Allelopathic effect of the aquatic macrophyte, Stratiotes aloides, on natural phytoplankton. Freshwater Biology 51: 554–561.
- Nielsen, L.T., Borum, J., 2008. Why the free floating macrophyte Stratiotes aloides mainly grows in highly CO2-supersaturated waters. Aquat. Bot. 89, 379–384.
- Orsenigo S., Gentili R., Smolders A. J. P., Efremov A., Rossi G., Ardenghi N. M. G., Citterio S., Abeli T. 2016. Reintroduction of a dioecious aquatic macrophyte (Stratiotes aloides L.) regionally extinct in the wild. Interesting answers from genetics. Aquatic Conservation Marine and Freshwater Ecosystems 27 (1), 10–23.
- Preston, C.D., Croft, J.M., 1997. Aquatic Plants in Britain and Ireland. Harley Books, Colchester.
- Rantala, M.J., Ilmonen, J., Koskimaki, S., and Tynkkynen, K. 2004. The macrophyte, Stratiotes aloides, protects larvae of dragonfly Aeshna viridis against fish predation. Aquat. Ecol. 38: 77–82.
- Renman, G., 1989. Life histories of two clonal populations of Stratiotes aloides L. Hydrobiologia 185, 211–222.
- Sarneel, J.M., 2013. The dispersal capacity of vegetative propagules of riparian fen species. Hydrobiologia. 710, 219–225. https://doi.org/10.1007/s10750-012-1022-3
- Skwierawski, A., Skwierawska, M., 2013. The role of Hydrocharitetum morsus-ranae in shaping the chemical composition of surface waters. Pol. J. Environ. Stud. 22 (6), 1825–1833.
- Smolders, A.J.P.; den Hartog, C.; Roelofs, J.G.M. 1995. Observations on fruiting and seed-set of Stratiotes aloides L. in The Netherlands. Aquat. Bot. 51, 259–268.
- Smolders, A.J.P., Lamers, L.P.M., den Hartog, C., Roelfos, J.G.M., 2003. Mechanisms involved in the decline of Stratiotes aloides L. in the Netherlands: sulphate as a key variable. Hydrobiology 506 (1-3), 603–610.
- Snyder, E., A. Francis et S.J. Darbyshire, 2016. Biology of invasive alien plants in Canada. 13. Stratiotes aloides L. Canadian Journal of Plant Science, 96 : 225-242.
- Strzałek, M., Koperski, P., 2009. The Stratiotes aloides L. Stand as a habitat in oxbow lake Bużysk. Aquat. Bot. 90 (1-6).
- Suhonen, J., Suutari, E., Kaunisto, K.M., and Krams, I. 2013. Patch area of macrophyte Stratiotes aloides as a critical resource for declining dragonfly Aeshna viridis. J. Insect Conserv. 17: 393–398.
- Sviridenko, V.G., Lapitskaya, S.K., Avseenko, S.V., and Tolkachev, V.I. 1987. Chemical characterization of aquatic plants and helophytes eaten by the European beaver. Rastit. Resur. 23: 621–625.
- Toma, C., 2006. Distribution and comparison of two morphological forms of Stratiotes aloides L. Biodiv. Res. Conserv. 3-4, 251–257.
- van der Winden, J. 2000. Een evaluatie van nestvlotjes voor de zwarte stern. De Levende Natuur. 101: 12–15.
- Weissflog, N., and E. Sager. 2016. An investigation of the reproductive ecology of water soldier in the Trent River, Ontario, Canada. Journal of Aquatic Plant Management 54: 72-77
- Yamalov, S.M., Golovanov, Ya.M., Baktybaeva, Z.B., Petrov, S.S., 2014. Aquatic vegetation of South Urals (Republic of Bashkortostan) I. Classes Lemnetea and charetea. Vegetation of Russia. 24, 124–141.
Webographie :
- MNHN & OFB . 2003-2023. Sheet of Stratiotes aloides L., 1753. Inventaire national du patrimoine naturel (INPN).
Website: https://inpn.mnhn.fr/espece/cd_nom/125219 – Le 22 juin 2023


