Environ 1460 espèces marines ont été signalées comme introduites dans les eaux européennes. Si certaines ne se sont pas établies, d’autres ont proliféré. Du fait de leurs effets sur la diversité et le fonctionnement des écosystèmes marins, les espèces non-indigènes (ENI) marines font l’objet de nombreuses recherches et réglementations. Cet article présente un état des lieux de la situation et de la surveillance mise en place, dans le contexte particulier de la Directive Cadre « Stratégie pour les Milieux Marins » de 2008, l’un des 11 descripteurs de cette directive étant entièrement dédié aux espèces non-indigènes en tant qu’indicateur de pression sur les écosystèmes marins côtiers.
Les espèces marines introduites : de la nécessité d’une gestion et une surveillance adaptées.
Un corollaire de la mondialisation des échanges
Les introductions d’espèces en milieu marin liées aux activités humaines (commerce, transports etc.) ne sont pas un processus nouveau mais elles n’ont cessé de s’accroitre au cours du 20ième siècle (Figure 1).
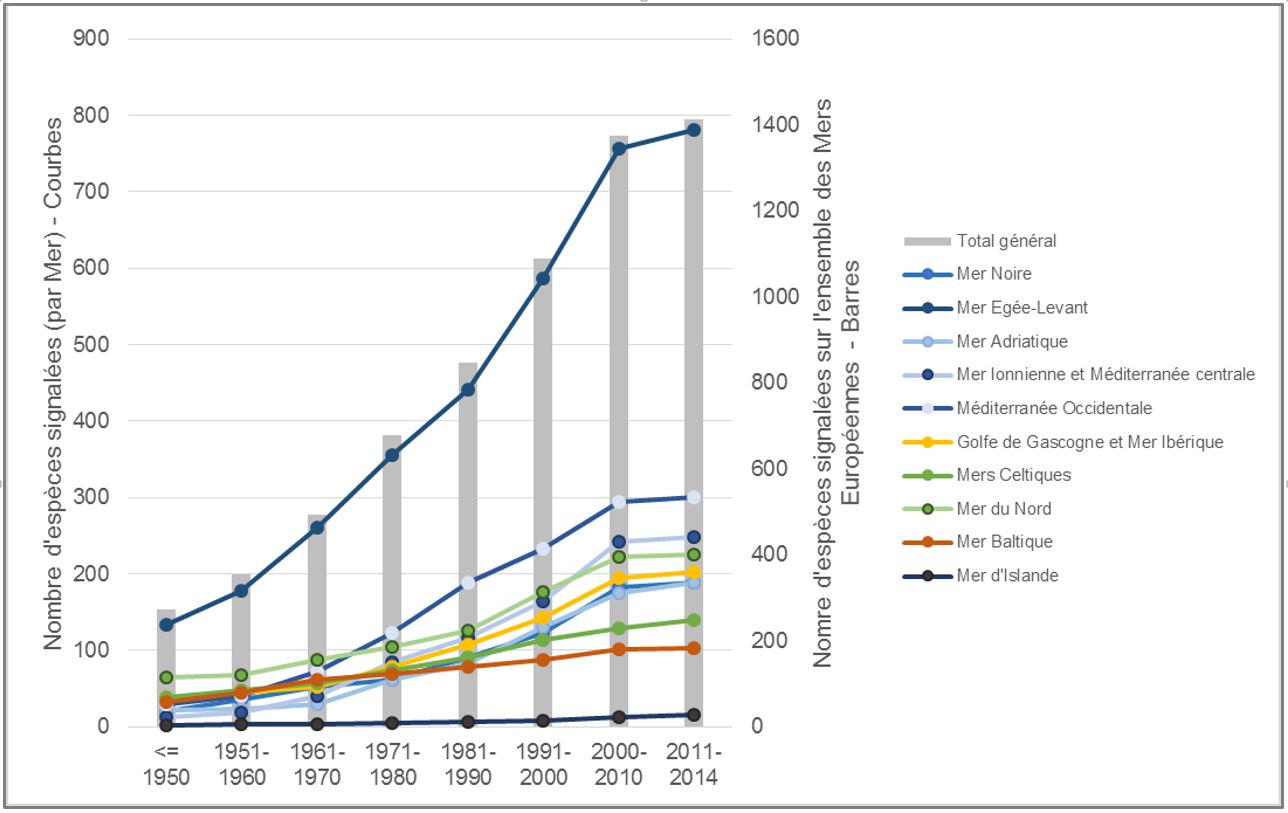

L’invention des bateaux à coque d’acier a été décisive : ils ont permis d’utiliser de l’eau de mer dans les ballasts –servant à équilibrer les navires en mer en fonction de leur charge, et cette eau a permis le transport interocéanique de très nombreuses espèces marines. En Europe, et en particulier en France, une augmentation des introductions s’est également produite dans les années 1960-1980 avec des introductions intentionnelles d’espèces en vue d’aquaculture, au premier rang desquelles l’Huitre creuse Crassostrea (Magallana) gigas. Ces introductions délibérées ont également été la source d’un très grand nombre d’introductions accidentelles d’espèces accompagnatrices de ces espèces cultivées. Ainsi en France, 50 % de ces introductions seraient expliquées par le développement de l’aquaculture (Nunes et al., 2014).
A l’échelle des mers européennes, 44 % des introductions sont néanmoins dues aux navires (commerce et plaisance), 33 % aux canaux et 13 % à l’aquaculture. Il existe des disparités régionales importantes, comme souligné plus haut avec le rôle de l’aquaculture en France, mais aussi très bien illustrées par le rôle du canal de Suez, premier vecteur d’introduction en Méditerranée orientale (Nunes et al., 2014). A l’exclusion de cette région, trafic maritime et aquaculture restent les vecteurs d’introductions les plus importants, à l’instar de ce qui est observé à une échelle mondiale (Molnar et al., 2008). Il n’est ainsi pas étonnant que l’augmentation des introductions en milieu marin soit bien corrélée à l’accroissement des échanges commerciaux maritimes internationaux (Nunes et al., 2014).
Lacunes de connaissance et biais d’observation
A ce jour, sur l’ensemble des mers européennes, environ 1460 espèces marines introduites ont donc été répertoriées (EASIN ; EEA, 2015 ; Katsanevakis et al., 2013). Néanmoins, ce chiffre souffre de lacunes de connaissance et de nombreux biais d’observation liées entre autres à 1) une expertise taxinomique en déclin, fragilisant notre capacité à détecter et identifier ces nouvelles espèces non-indigènes, et ce d’autant plus qu’elles sont nombreuses dans des groupes taxinomiques particulièrement complexes et sur lesquels l’expertise taxinomique est rare (ex. ascidies, bryozoaires, hydraires), 2) la difficulté d’accessibilité au milieu marin hors de la zone intertidale, et la difficulté de réaliser des observations dans des habitats où les techniques traditionnelles d’échantillonnage depuis la surface ne sont pas utilisables (ex. milieux rocheux subtidaux), 3) la mise en évidence de nombreuses espèces cryptiques (non reconnaissables sur la base de critères morphologiques). En outre, il existe de nombreuses espèces cryptogènes (espèces dont le statut indigène ou non-indigène ne peut être établi avec certitude par méconnaissance de leur aire de distribution naturelle), ce qui complique l’état des lieux.
Les points clés de la gestion
Les conséquences des introductions en milieu marin sont difficiles à qualifier et quantifier. (Ojaveer et al., 2015). Pour les rares espèces pour lesquelles une analyse des impacts a pu être réalisée au niveau européen, les effets sont souvent multiples, en cascade et dynamiques (ex : alternance de phases d’expansion et de régression) (Katsanevakis et al., 2014). L’éradication d’une espèce marine introduite a été très rarement réalisée avec succès, notamment du fait de leur identification trop tardive, de l’impossibilité à contrôler les nombreux vecteurs d’expansion (ex. plaisance) et de traits d’histoire de vie ou cycle de vie facilitant une propagation rapide (ex. dispersion par les phases larvaires). Ces différents constats tant au niveau de la dynamique rapide des introductions et de propagation, du manque de contrôle des vecteurs que des lacunes de connaissance et biais d’observation sont à l’origine de contraintes particulières en termes de gestion. Il existe en particulier un consensus 1) sur la nécessité d’une politique de prévention (dite de contrôle « pré-frontière ») dirigée sur les vecteurs d’introduction (Encadré 1) et 2) la nécessité d’une détection la plus précoce possible, donc ciblant les « points chauds » d’introduction au premier rang desquels se trouvent les zones portuaires (commerce et plaisance) et les zones aquacoles (Ojaveer et al., 2015).
| 1. Des règlementations ciblant spécifiquement les vecteurs d’introduction en milieu marin
Commerce maritime et échanges aquacoles sont reconnus comme les principaux vecteurs d’introduction. Ce constat est partagé par des organisations professionnelles notamment l’Organisation Maritime Internationale (OMI) qui en 2004 a proposé une convention internationale pour la gestion des eaux de ballast. Devant être signée par un minimum de 30 états dont les flottes représenteraient au moins 35 % du tonnage de la flotte mondiale, la convention n’est entrée en vigueur qu’en 2017. La France, qui y avait adhéré en 2008, a promulgué un décret pour sa mise en œuvre (décret no.2017-1347 du 18 septembre 2017).
L’aquaculture a également été au centre de règlementations dédiées en particulier le « Règlement européen relatif à l’utilisation en aquaculture des espèces exotiques et des espèces localement absentes » (no.708/2007 du conseil du 11 juin 2007) qui fixe un cadre pour les pratiques aquacoles concernant des espèces non-indigènes ou localement absentes. Ce règlement s’inspire du code de conduite pour les introductions et transferts d’organismes marins du Conseil international pour l’exploration de la mer (CIEM) et du « Code of Practice and Manual of Procedures for consideration of introductions and transfers of marine and freshwater organisms » de la Commission européenne consultative pour les pêches dans les eaux intérieures (CECPI). Ce règlement exempte de toute procédure deux espèces marines, l’Huitre creuse japonaise et la Palourde japonaise. Pour toutes les autres espèces, un dossier de demande de permis d’introduction est à constituer. |
Cadre dédié aux ENI et en milieu marin : la DCSMM
Les réglementations ciblant les espèces non-indigènes en vigueur en France
Les travaux sur les espèces exotiques envahissantes ont depuis longtemps montré les impacts souvent irréversibles que leur présence pouvait causer sur la biodiversité et les écosystèmes (Bax et al., 2003 ; Molnar et al., 2008 ; Katsanevakis et al., 2014). C’est donc dans un objectif de sauvegarde de la biodiversité que la Commission européenne a publié en 2014 le règlement relatif à la prévention, à la gestion de l’introduction et de la propagation des espèces exotiques envahissantes (RUE n°1143/2014). Ce règlement identifie actuellement 49 espèces exotiques envahissantes et bien qu’il cible les écosystèmes terrestres, dulçaquicoles et marins, aucune espèce dont l’ensemble du cycle de vie a lieu en milieu marin n’est présente dans cette liste. Seul le Crabe chinois Eriocheir sinensis peut se trouver en milieu marin lors de sa période de reproduction. Pour accompagner ce règlement européen, la France a mis en place une Stratégie nationale relative aux espèces exotiques envahissantes, qui vise à protéger les écosystèmes des risques et des effets des espèces exotiques envahissantes. Bien que pris en compte dans cette stratégie, les écosystèmes marins ne sont encore que très peu concernés, probablement (1) en raison de l’absence d’espèce marine dans la liste du règlement européen, et (2) parce que la Directive européenne Cadre Stratégie pour le Milieu Marin (DCSMM, Directive 2008/56/CE) propose depuis 2012 un cadre dédié à la pression exercée par les espèces exotiques envahissantes, ici appelées « espèces non-indigènes », en milieu marin.
La DCSMM vise à obtenir et/ou maintenir un bon état écologique des eaux marines pour 2020. Elle est composée pour cela de 11 « descripteurs » d’état ou de pression : biodiversité, espèces non-indigènes, espèces exploitées, réseaux trophiques, eutrophisation, intégrité des fonds, conditions hydrographiques, contaminants/milieu, contaminants/aliments, déchets et bruit ; et se divise en 5 volets : (1) une évaluation de l’état écologique ; (2) la définition du bon état écologique ; (3) un programme de surveillance dont les données acquises permettent d’alimenter le calcul d’indicateurs pour évaluer l’état écologique ; (4) la détermination des objectifs environnementaux et (5) des mesures qui en découlent au travers d’un programme de mesures. L’ensemble de ces volets est révisé à chaque cycle, c’est-à-dire tous les six ans, pour les quatre sous-régions marines françaises (Figure 2).
Le descripteur 2 est dédié aux espèces introduites en tant que pression. Il a pour objectif que « les espèces non-indigènes introduites par le biais des activités humaines à des niveaux qui ne perturbent pas les écosystèmes ». Pour déterminer si cet objectif est atteint, trois critères ont été définis (Décision UE 2017/848) :
- Critère D2C1: le nombre d’espèces non-indigènes nouvellement introduites dans le milieu naturel par le biais des activités humaines, par période d’évaluation (six ans).
- Critère D2C2: les abondances et répartitions spatiales des espèces non-indigènes établies, en particulier les espèces envahissantes, qui contribuent de manière notable aux effets néfastes sur certains groupes d’espèces ou grands types d’habitats.
- Critère D2C3: la proportion de groupes d’espèces ou l’étendue spatiale de grands types d’habitat subissant des altérations néfastes dues à la présence d’espèces non-indigènes, en particulier des espèces non-indigènes envahissantes.
A chaque critère est associé un ou plusieurs indicateur(s) permettant d’évaluer le bon état écologique. Le seul indicateur à ce jour opérationnel est le NIS3, permettant de répondre au critère D2C1. Il s’agit du nombre de (1) nouvelles signalisations (correspondant à la date de publication de la donnée) et (2) nouvelles observations (correspondant à la date d’échantillonnage) d’espèces non-indigènes par sous-région marine et par an.
|
2. Évaluation 2018 du bon état écologique pour les espèces non-indigènes Le premier cycle DCSMM de 6 ans est en train de se terminer. A ce stade, un processus d’évaluation est en cours, notamment pour le descripteur D2 concernant les espèces non-indigènes. Seul l’indicateur du critère 1 a pu être calculé ; il s’agit du nombre d’espèces non-indigènes nouvellement signalées entre 2012 et 2017 (Figure 3). Parmi ces introductions, le phylum des arthropodes est le plus représenté (Figure 4). Aucune surveillance à l’échelle nationale spécifiquement dédiée aux espèces non indigènes n’est à ce jour en place. Seules des données issues de la littérature ou de rapports ont pu être utilisées pour cette évaluation. Ceci n’a pas permis de statuer sur l’atteinte des objectifs dans les eaux marines françaises concernant les espèces non indigènes. Il est cependant important de noter que 34 nouvelles espèces marines ont été signalées ces six dernières années, dont 28 premières signalisations à l’échelle nationale. |
Suivis et surveillance des espèces marines introduites
A ce jour, les données de distribution et d’abondances d’espèces non-indigènes en France sont uniquement issues de programmes non dédiés, y compris de programmes de recherche, apportant de manière opportuniste des informations sur certaines espèces non-indigènes. Les programmes de recherche ciblent en général une seule espèce, un écosystème ou un habitat, avec pour objectif de répondre à une question spécifique de recherche, et n’ont pas pour objectif de contribuer à la surveillance stricto sensu. De plus, leur non-pérennité, notamment due à leurs financements temporaires ou sur fonds propres, fragilise la durabilité des observations. La pérennisation des observations est pourtant absolument indispensable dans tout programme de surveillance, notamment pour permettre de suivre l’expansion des ENI (voir encadrés 3 et 4).
|
3. Un exemple de suivi : le Crabe sanguin en Manche Le Crabe sanguin (Hemigrapsus sanguineus) est originaire du Japon. Il a été observé pour la première fois sur les côtes françaises en 1999 dans le port du Havre, où une population était installée (Breton et al., 2002). Un premier suivi de la distribution et de la densité de cette espèce a été effectué à l’été 2008, autour de la péninsule du Cotentin (Dauvin, 2009). Moins de 10 ans après sa découverte dans le port du Havre, la répartition du crabe était déjà étendue de La Hougue à Granville (Figure 5), avec des densités pouvant aller jusqu’à plus de 30 individus récoltés par groupe de 30 rochers à Querqueville.  Ce suivi a également été réalisé sur la partie Est de la façade Manche – Mer du Nord, montrant que l’espèce était présente jusqu’à la frontière Belge et même au-delà, avec des densités pouvant aller jusqu’à plus de 30 individus échantillonnés sous 30 rochers à la sortie du port de Dunkerque. Malgré les recommandations de Dauvin (2009) de surveiller la distribution et les densités de cette espèce au moins une fois par an, ce suivi n’a pu reprendre qu’en 2011 et 2012 (Figure 6 ; Gothland et al., 2013). Il est depuis régulièrement réalisé, en fonction des financements disponibles.
|

Contrairement à la France, de nombreux pays, européens et autres, ont déjà mis en place des systèmes de surveillance des espèces non-indigènes marines, ciblant l’ensemble des espèces non-indigènes ou une liste d’espèces considérée comme prioritaires (soit parce qu’avérées envahissantes, soit pour le risque important liée à leur introduction). C’est notamment le cas en Australie (NIMPCG, 2010), en Nouvelle-Zélande, au Danemark (Andersen et al., 2017), en Irlande (Minchin, 2007) ou en Angleterre (Bishop et al., 2015 a, b). Les méthodes de suivi utilisées peuvent se diviser en deux groupes : celles ciblant des espèces non-indigènes d’une part et celles où l’ensemble des communautés fait l’objet du suivi (inventaire exhaustif ou supposé tel). Les techniques mises en œuvre sont également diverses : échantillonnage et observation au laboratoire, qui peuvent concerner les communautés planctoniques, pélagiques, benthiques (des substrats meubles et durs), ou des observations réalisées sur le terrain en temps limité, ciblant des organismes macroscopiques. Cette dernière technique est la base des Évaluations en Temps Limité (Encadré 4).
Dans le cadre de la DCSMM, un programme de surveillance dédié aux espèces non-indigènes marines dans les eaux métropolitaines françaises est en cours de développement. La priorité a été mise sur la surveillance des zones dites « à risques », c’est-à-dire les ports de commerce, les ports de plaisance et les zones de cultures marines. Comme évoqué plus haut, ces zones sont en effet les points chauds d’introduction (les portes d’entrée). Il est prévu d’y appliquer à la fois la méthode d’Évaluation en Temps Limité sur une liste fermée afin de réaliser des observations avec un maillage fin (notamment en appui du D2C2), mais aussi des méthodes d’échantillonnages et analyses au laboratoire permettant un inventaire plus approfondi (notamment en appui du D2C1) réalisables sur un nombre plus limité de sites (Encadré 4).
La mise en place d’une telle surveillance nécessite des travaux préparatoires. Par exemple, pour les ETL sur liste fermée, ces préalables sont l’élaboration d’une liste d’espèces cibles et la formation des personnes à leur identification sur le terrain. Cette liste concerne des espèces déjà présentes ou pouvant être introduites depuis des régions ou mers limitrophes, et considérées comme particulièrement importantes à surveiller compte tenu par exemple de leur impact avéré dans d’autres régions. En outre, le développement et l’utilisation d’outils moléculaires de type barcoding et métabarcoding (Encadré 5) pourraient s’avérer particulièrement utiles (Darling et al., 2017), notamment pour valider l’identification d’espèces nouvelles en tant qu’espèces introduites (et donc en support de D2C1) ainsi que pour réaliser, par l’analyse d’échantillons environnementaux, des recherches d’ENI dans des milieux difficiles d’accès et augmenter la pression d’observation dans le milieu (et ainsi venir en appui de D2C2). Ces outils ont déjà fait leurs preuves dans différents contextes, notamment l’identification de nouvelles espèces introduites, et ils sont de plus en plus largement utilisés dans les milieux aquatiques dans le cadre de programmes de surveillance et de gestion (cf. Séminaire « ADN environnemental – AFB).
En conclusion, quelques points-clés sont à souligner : diverses lacunes de connaissance et des biais d’observation subsistent mais des progrès important ont été réalisés au cours de la dernière décennie concernant la connaissance des processus d’introductions en milieu marin, dont le rôle de la pression en propagules, qui ont permis de mieux cadrer les politiques de gestion et de surveillance. De nouveaux cadres règlementaires ont également vu le jour. Ces connaissances et ces cadres devraient permettre de mettre en place des programmes de surveillance qui devront intégrer de nouvelles méthodes d’observation et de nouveaux outils pour pallier les difficultés (ex : validation d’identification, accroitre la pression d’observation), ceci pour gagner en efficacité et permettre de meilleures prévention et détection précoce, deux clés pour la gestion des introductions biologiques en milieu marin.
Rédaction : Cécile Massé, UMS Patrinat (AFB, CNRS, MNHN) et Frédérique Viard (CNRS – Station biologique de Roscoff)
Relectures : Doriane Blottière (UICN France) et Alain Dutartre (Expert indépendant).
Bibliographie
- Andersen, J.H., Brink, M., Kallenbach, E., Hesselsøe, M., Knudsen, S.W., Støttrup, J.G., Møller, P.R., Eikrem, W., Fagerli, C., Oug, E. (2017). Sampling protocol for monitoring of non-indigenous species in selected Danish Harbours. 10.13140/RG.2.2.15655.85920
- Arenas, F., Bishop, J. D. D., Carlton, J. T., Dyrynda, P. J., Farnham, W. F., Gonzalez, D. J., Jacobs, M. W., Lambert, C., Lambert, G., Nielsen, S. E., Pederson, J. A., Porter, J. S., Ward, S. & Wood, C. A. . (2006). Alien species and other notable records from a rapid assessment survey of marinas on the south coast of England. Journal of the Marine Biological Association of the United Kingdom, 86, 1329-1337.
- Bax, N., Williamson, A., Aguero, M., Gonzalez, E. & Geeves, W. (2003). Marine invasive alien species: a threat to global biodiversity. Marine Policy, 27: 313-323
- Bishop, J. D. D., Roby, C., Yunnie, A. L. E., Wood, C. W., Lévêque, L., Turon, X., & Viard, F. (2013). The Southern Hemisphere ascidian Asterocarpa humilis is unrecognised but widely established in NW France and Great Britain. Biological Invasions, 15(2): 253-260. doi:DOI: 10.1007/s10530-012-0286-x
- Bishop, J., Wood, C. A., Lévêque, L., Yunnie, A. L. E., & Viard, F. (2015 a). Repeated rapid assessment surveys reveal contrasting trends in occupancy of marinas by non-indigenous species on opposite sides of the western English Channel. Marine Pollution Bulletin, 95: 699-706 doi:10.1016/j.marpolbul.2014.11.043
- Bishop, J. D., Wood, C. A., Yunnie, A. L., & Griffiths, C. A. (2015 b). Unheralded arrivals: non-native sessile invertebrates in marinas on the English coast. Aquatic Invasions, 10(3): 249-264.
- Breton G., Faasse M., Noel P., Vincent T. (2002) A new alien crab in Europe: Hemigrapsus sanguineus (Decapoda : Brachyura : Grapsidae). Journal of crustacean biology, 22(1): 184-189.
- Carlton, J. T. (1996). Biological invasions and cryptogenic species. Ecology, 77(6): 1653-1655.
- Darling, J. A., Galil, B. S., Carvalho, G. R., Rius, M., Viard, F., & Piraino, S. (2017). Recommendations for developing and applying genetic tools to assess and manage biological invasions in marine ecosystems. Marine Policy, 85: 54-64. doi:10.1016/j.marpol.2017.08.014
- Dauvin, J.C. (2009) Establishment of the invasive Asian shore crab Hemigrapsus sanguineus (De Haan, 1835) (Crustacea: Brachyura: Grapsoidea) from the Cotentin Peninsular, Normandy, France. Aquatic Invasions, 4(3): 467-472
- Dauvin, J.C., Tous Rius, A., Ruellet, T. (2009) Recent expansion of two invasive crabs species Hemigrapsus sanguineus (De Haan, 1835) and H. takanoi Asakura and Watanabe 2005 along the Opal Coast, France. Aquatic Invasions, 4(3): 451-465
- Dias, J. P., Fotedar, S., Munoz, J., Hewitt, M. J., Lukehurst, S., Hourston, M., Snow, M. (2017). Establishment of a taxonomic and molecular reference collection to support the identification of species regulated by the Western Australian Prevention List for Introduced Marine Pests. Management of Biological Invasions, 8(2): 215–225.
- Gothland, M., Dauvin, J.C., Denis, L., Jobert, S., Ovaert, J., Pezy, J.P., Spilmont, N. (2013) Additional records and distribution (2011-2012) of Hemigrapsus sanguineus (De Haan, 1835) along the French coast of English Channel. Management of Biological Invasions, 4(4): 305-315
- Katsanevakis, S., Gatto, F., Zenetos, A., & Cardoso, A. C. (2013). How many marine aliens in Europe? Management of Biological Invasions, 4(1): 37-42.
- Katsanevakis, S., Wallentinus, I., Zenetos, A., Leppäkoski, E., Çinar, M. E., Oztürk, B., Cardoso, A. C. (2014). Impacts of invasive alien marine species on ecosystem services and biodiversity: a pan-European review. Aquatic Invasions, 9(4): 391-423. doi:10.3391/ai.2014.9.4.01
- McGlashan, D. J., Ponniah, M., Cassey, P., & Viard, F. (2008). Clarifying marine invasions with molecular markers: an illustration based on mtDNA from mistaken calyptraeid gastropod identifications. Biological Invasions, 10(1): 51-57. doi:10.1007/s10530-007-9106-0
- Massé, C. & Guérin, L. (2017). Evaluation 2018 de la pression biologique par les espèces non indigènes marines en France Métropolitaine. Muséum National d’Histoire Naturelle (UMS 2006 Patrimoine Naturel), 84p + annexes
- Molnar, J. L., Gamboa, R. L., Revenga, C., & Spalding, M. D. (2008). Assessing the global threat of invasive species to marine biodiversity. Frontiers in Ecology and the Environment, 6(9): 485-492. doi:doi:10.1890/070064.
- NIMPCG (2010) Australian marine pest monitoring guidelines. Version 2. The National Introduced Marine Pest Coordination Group, Commonwealth of Australia, Camberra, 47 pp
- Nunes, A. L., Katsanevakis, S., Zenetos, A., & Cardoso, A. C. (2014). Gateways to alien invasions in the European seas. Aquatic Invasions, 9(2): 133-144. doi:10.3391/ai.2014.9.2.02
- Ojaveer, H., Galil, B. S., Campbell, M. L., Carlton, J. T., Canning-Clode, J., Cook, E. J., Ruiz, G. (2015). Classification of Non-Indigenous Species Based on Their Impacts: Considerations for Application in Marine Management. PLoS Biol, 13(4): e1002130. doi:10.1371/journal.pbio.1002130
- Ojaveer, H., Galil, B. S., Minchin, D., Olenin, S., Amorim, A., Canning-Clode, J., Zenetos, A. (2014). Ten recommendations for advancing the assessment and management of non-indigenous species in marine ecosystems. Marine Policy, 44: 160-165. doi:10.1016/j.marpol.2013.08.019









