La Rangia d’Atlantique, Rangia cuneata, est une espèce de bivalve d’eau saumâtre originaire du golfe du Mexique. Mesurant jusqu’à 5 cm, elle ressemble à une petite palourde asymétrique et peut devenir envahissante (jusqu’à 4000 individus /m²). Elle a été observée pour la première fois en Europe en 2005, puis a progressivement colonisé la mer Baltique. Sa présence vient d’être confirmée en France, où son introduction remonterait à 2017.
 Origine et répartition mondiale
Origine et répartition mondiale
La Rangia d’Atlantique est originaire du golfe du Mexique, mais qui présentait au cours du Pléistocène, une aire de répartition beaucoup plus vaste sur la côte Est de l’Amérique. Elle a été introduite sur la côte atlantique de l’Amérique du Nord, de la côte Est de la Floride (1960) à l’embouchure de la rivière Hudson (1988), puis en Europe à partir de 2005.
Colonisation en Europe
Elle a été découverte en Europe pour la première fois en Belgique, en 2005 (Figure 1), au sein d’un équipement de biomonitoring placé dans l’estuaire de la Scheldt (port d’Anvers, Verween et al., 2006) pour une étude de surveillance sur la Moule d’Amérique, Mytilopsis leucophaeata. Plusieurs auteurs estiment cependant que son arrivée devait remonter à 1999 ou 2000. Elle a ensuite été observée en plusieurs localisations en Belgique et aux Pays-Bas, au sein de canaux puis de grands ports comme Rotterdam (Gittenberger et al., 2014). En 2010, elle est observée dans la Vistule, entre la Pologne et l’enclave russe de Kaliningrad, où sa population a rapidement augmenté (Rudinskaya & Gusev 2010), puis en Lituanie en 2013 (Solovjova, 2014) et en Estonie en 2016 (Möller & Kotta, 2017). Après plusieurs observations sur la côte Ouest de la Baltique, elle est ensuite repérée sur la côte Sud, en Allemagne à partir de 2013 (Wiese et al., 2016), puis sur la côte Est (en Suède – Florin, 2017 ; von Proschwitz et al., 2018). L’espèce a également été signalée dans le Lincolnshire en Angleterre (Willing 2015).

Situation en France
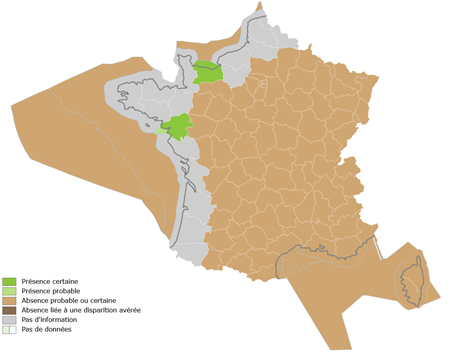
L’espèce a été signalée pour la première fois le long des rives du canal de Caen à la mer à Benouville – Ranville le 9 août 2017 (Kerckhof et al., 2017). Sa présence et son établissement ont été confirmés à partir d’observations à Ouistreham (Faillettaz et al., 2020). Plus récemment, une petite population a été observée en Brière (M. Marquet & A. Petit, com. pers.), suggérant que l’espèce est probablement déjà largement plus répandue en métropole qu’on ne le pense (Fig. 2).
Description
Coquille à l’allure de palourde (Fig. 3), mesurant jusqu’à 5 cm, épaisse, ovale-triangulaire inéquilatérale, gris-brun, stries d’accroissement fines et régulières. Charnière avec une dent latérale striée transversalement, sinus palléal réduit.

Écologie
Espèce gonochorique, considérée comme adulte à partir de 17 mm (mâture dès la première année de vie). Se reproduit de mai à octobre. Les larves sont planctoniques. Longévité estimée à 4-8 ans. Peut vivre entre 0 et -124 mètres, habituellement à moins de deux mètres de profondeur (La Salle & Cruz 1985).
Surtout observée dans les milieux estuariens, R. cuneata est considérée comme une espèce d’eaux saumâtres (5-15 ‰, Swingle & Bland, 1974), bien qu’elle ait déjà été observée dans des eaux douces (<1 ‰) dans son aire d’origine (Wong et al., 2010). Adaptée à une large amplitude de salinité grâce à des mécanismes d’osmorégulation intra- et extra-cellulaires, son absence dans les milieux fortement salés s’expliquerait par un défaut de recrutement lorsque la salinité dépasse 14 ‰ (Christensen et al., 2020) ou par une mortalité directe (Tang & Aldridge 2020, pour qui l’espèce ne survivrait pas plus d’un mois à l’exposition à l’eau de mer, salée à 32‰). Sa présence dans des eaux à 1,2 ‰ au sein de milieux récemment colonisés (ex. Willing 2015), ainsi que les expériences de chocs osmotiques menées en laboratoire par Tang & Aldridge (2020) suggèrent qu’elle pourrait s’acclimater aux eaux douces à l’instar d’autres espèces d’origine marine comme la Moule quagga, Dreissena rostriformis bugensis.
Principaux vecteurs d’introduction
Les principaux vecteurs d’introduction seraient au stade larvaire le transport via les eaux de ballast et au stade adulte le transport d’huitres et de matériel ostréicole (Carlton 1992 ; Pfitzenmeyer & Drobeck 1964).
Impact potentiel
Les fortes densités que peut atteindre localement (jusqu’à 4000 ind./m2) une population de ce puissant filtreur (Kemp et al., 2018) peuvent engendrer des effets directs et indirects importants sur les milieux colonisés. Comme beaucoup de bivalves envahissants R. cuneata peut être considérée comme une espèce ingénieure (Sousa et al., 2009). La filtration induit un éclaircissement important de la colonne d’eau qui favorise le développement d’herbiers et s’accompagne d’un transfert de la biomasse du seston vers le benthos. Les coquilles de R. cuneata peuvent permettre l’installation d’autres espèces qui étaient jusqu’alors défavorisées par l’absence de point d’ancrage au sein d’un substrat meuble. Les milieux saumâtres estuariens seraient tout particulièrement fragiles du fait d’une faible diversité de filtreurs aux densités habituellement limitées (Kemp et al., 2018).
Statut réglementaire en France
A ce jour, l’espèce ne fait l’objet d’aucune réglementation particulière.
Pour tout signalement de l’espèce, utilisez l’application INPN-Espèces
Contact : Vincent Prié, prie.vincent@gmail.com
Rédaction : Vincent Prié, MNHN, et Jean-Nicolas Beisel, ENGEES
Relecture : Nicolas Poulet, OFB, Madeleine Freudenreich et Emmanuelle Sarat, Comité français de l’UICN, Alain Dutartre, expert indépendant.
Pour en savoir plus :
- Fiches d’identification
Consultez la fiche de l’INPN et celle du Centre de ressources EEE.
- Bibliographie
- Carlton, J.T. 1992.- Introduced marine and estuarine mollusks of North America: an end-of-the-20th-century perspective. Journal of Shellfish Research 11 (2): 489-505
- Christensen, A. B., & M. I. Pyne 2020.- The effect of a permanent saltwater barrier on Rangia cuneata, an indicator species of brackish conditions. Estuarine, Coastal and Shelf Science 106800.
- Faillettaz, R., C. Roger, M. Mathieu, J. Robin & K. Costil. 2020.- Establishment and population features of the non-native Atlantic rangia, Rangia cuneata (Mollusca: Bivalvia), in northwestern France. Aquatic Invasions 15 (3), pp.367-381.
- Florin, A. B., K. Mo, F. Svensson, E. Schagerström, L. Kautsky & L. Bergström, 2013.- First record of Conrad’s false mussel, Mytilopsis leucophaeata (Conrad, 1831) in the southern Bothnian Sea, Sweden, near a nuclear power plant. Bioinvasion Records 2: 303–309.
- Hopkins, S. H. & J. D. Andrews 1970.- Rangia cuneata on the east coast: thousand mile range extension, or resurgence? Science 167: 868-869
- Kemp, J. S., F. Tang & D. C. Aldridge 2018.- Quantifying invader impact: Applying functional response metrics to a rapidly spreading non‐native species. Freshwater Biology, 63(12), 1514-1522.
- Kerckhof, F., M. Devleeschouwer & N. Hamers 2017.- De Amerikaanse brakwaterstrandschelp Rangia cuneata (G. B. Sowerby, 1832) aangetroffen in Frankrijk. De Strandvlo 37: 141–145
- La Salle, M.W. & A.A. de la Cruz 1985.- Species profiles: life histories and environmental requirements of coastal fishes and invertebrates (Gulf of Mexico). Common rangia. Biological Report 82: 11-31
- Möller, T. & J. Kotta 2017.- Rangia cuneata (G.B. Sowerby I, 1831) continues its invasion in the Baltic Sea: the first record in Pärnu Bay, Estonia. Bioinvasions Records 6 (2) : 167-172
- Pfitzenmeyer, H.T. & K.G. Drobeck 1964.- The occurrence of the brackish water clam, Rangia cuneata, in the Potomac River, Maryland. Chesapeake Science 5(4): 209-212
- von Proschwitz, T. 2018.- Two invasive brackish water mussel species in Sweden: Rangia cuneata (G. B. Sowerby I) and Mytilopsis leucophaeata (Conrad). Journal of Conchology 43: 111–113.
- von Proschwitz, T. & N. Wengström 2020.- Zoogeography, ecology, and conservation status of the large freshwater mussels in Sweden. Hydrobiologia.
- Rudinskaya L.V. & A.A. Gusev 2012.- Invasion of the North American wedge clam Rangia cuneata (GB Sowerby I, 1831) (Bivalvia: Mactridae) in the Vistula Lagoon of the Baltic Sea. Russian Journal of Biological Invasions 3: 220-229.
- Solovjova, S. 2017.- Rangia cuneata introduction to Lithuania/Baltic Sea. AquaNIS. Editorial Board, Information System on Aquatic Non-INDIGENOUS and Cryptogenic Species, World Wide Web Electronic Publication (2014)
- Sousa, R., J. L. Gutiérrez & D. C. Aldridge 2009.- Non-indigenous invasive bivalves as ecosystem engineers. Biological Invasions 11(10), 2367-2385.
- Swingle, H. A., D. G. & Bland 1974.- Distribution of the estuarine clam Rangia cuneata Gray in coastal waters of Alabama. Alabama Marine Resource Bulletin 10, 9-16.
- Tang, F. & D. C. Aldridge 2020.- Using osmotic shock to control invasive aquatic species. Journal of Environmental Management, in press.
- Verween, A., F. Kerckhof, M. Vincx & S. Degraer 2006.- First European record of the invasive brackish water clam Rangia cuneata (G.B. Sowerby I, 1831) (Mollusca: Bivalvia), Aquatic Invasions 1: 198-203
- Wiese, L., O. Niehus, B. Faass & V. Wiese 2016.- Ein weiteres Vorkommen von Rangia cuneata in Deutschland (Bivalvia: Mactridae). Schriften zur Malakozoologie 29 : 53-60
- Willing, M.J. 2015. Two invasive bivalves, Rangia cuneata (GB Sowerby I, 1831) and Mytilopsis leucophaeta (Conrad, 1831), living in freshwater in Lincolnshire, Eastern England. Journal of Conchology 42 (2): 189-192.
- Wong, W. H., N. N. Rabalais & R. E. Turner 2010.- Abundance and ecological significance of the clam Rangia cuneata (Sowerby, 1831) in the upper Barataria Estuary (Louisiana, USA). Hydrobiologia 651(1): 305-315.


