Originaire des côtes de l’Atlantique (de la Mauritanie à la Norvège), le Crabe vert (Carcinus maenas -Linnaeus, 1758) est également appelé Crabe vert européen ou Crabe enragé, de par son comportement « batailleur ».
L’espèce a été largement introduite dans de nombreuses régions du globe, de façon accidentelle ou volontaire. En Amérique du Nord, l’espèce est apparue au début du 20ème siècle, dans la Baie de Fundy (Nouvelle-Ecosse), puis à l’Est du Canada, dans les années 1950. Son aire de répartition a cru rapidement avec l’augmentation du trafic maritime et grâce à sa grande capacité d’adaptation à différents milieux. Le Crabe vert a progressivement fait son apparition dans le golfe du Saint-Laurent en Nouvelle-Écosse en 1994, puis a rapidement atteint les côtes de Terre Neuve, jusqu’à coloniser la Baie de Placentia en 2007.
L’espèce a été découverte à Saint-Pierre et Miquelon en 2013. Sa présence peut avoir des conséquences importantes sur la biodiversité des eaux de l’archipel ainsi que sur l’économie marine aquacole.
Le Crabe vert… n’est pas toujours vert !
Le Crabe vert est un crabe de taille moyenne appartenant à la famille des Portunidae.
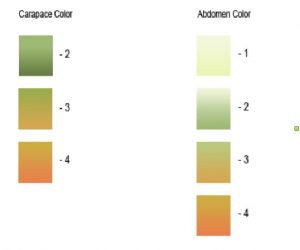
La carapace des individus adultes atteint environ 6 cm de long et 9 cm de largeur, avec un dimorphisme sexuel prononcé (femelles plus grosses que les mâles).
Le crabe vert n’est pas forcément vert ! La couleur de sa carapace peut varier du vert au marron, en passant par l’orange voire le rouge.
On distingue nettement le Crabe vert (Carcinus maenas) du crabe canadien natif, le Crabe de roche (Cancer irroratus) grâce à sa carapace trapézoïdale, ses cinq épines antérolatérales de chaque côté des yeux (le crabe de roche en possède 9 plus plates de chaque côté) et les trois petites protubérances arrondies entre ses yeux. Sa dernière paire de pattes est légèrement aplatie et garnie de soies, ce qui le rend apte à la nage.

Un cycle de vie entre benthos et pélagos
Le Crabe vert peut vivre entre 4 et 7 ans (Berrill, 1982 ; Grosholz et Ruiz, 1996 ; Behrens Yamada et al., 2001). Le cycle de vie alterne entre adultes benthiques et larves planctoniques. Sa reproduction a lieu à partir de la mi-août, pendant la période de mue des femelles, qui arborent une nouvelle carapace complètement molle. Ceci les rendent vulnérable aux prédateurs et elles se mettent donc à l’abri et ne sortent qu’une fois leur carapace durcie (Paille et al. 2006). Deux productions d’œufs annuelles sont assurées par des femelles reproductrices pouvant chacune porter jusqu’à 185 000 œufs à chaque fois (Cohen et Carlton, 1995). Le développement larvaire se produit entre 9°C et 22,5°C (Dawirs et al., 1986 ; De Rivera et al., 2007), dans les eaux côtières pendant plus de 50 jours, jusqu’à un maximum de 82 jours en laboratoire (Williams, 1967 ; De Rivera et al., 2007).
Les larves effectuent une migration verticale active qui permet leur exportation hors estuaires (Zeng et Naylor, 1996 ; Quieroga et al., 1997). Généralement, elles se trouvent dans les eaux côtières à des profondeurs de 20 à 25 m au cours de la journée et de 30 à 45 m au crépuscule (Quieroga, 1996). Elles reviennent ensuite près des côtes et se métamorphosent en crabes juvéniles (Quieroga, 1998).
À des températures entre 2 et 10oC, les individus adultes de Crabe vert cessent de s’alimenter et de croître. Les populations estuariennes entreprennent alors une migration hivernale au large vers les eaux côtières profondes et chaudes (Broekhuysen, 1936 ; Eriksson et Edlund, 1977 ; Berrill, 1982 ; Sharp et al., 2003).
Ces activités migratoires journalières et saisonnières rendent difficiles la détection de l’espèce et l’estimation de la taille de ses populations.
De grandes capacités d’adaptation
Le Crabe vert se trouve généralement en eau peu profonde, proche du rivage. Il s’en éloigne l’hiver pour s’enfouir dans le sable et se protéger du froid. Il préfère les zones protégées des vagues avec un fond de sable, de vase ou de petits galets, avec présence de zostères. Il affectionne donc particulièrement les lagunes marines. L’espèce a colonisé avec succès des habitats côtiers et estuariens variés, abrités ou semi-exposés, tels que les zones rocheuses intertidales, des zones sans végétation intertidale, des milieux sub-tidaux (boue et sable), des marais salants et des herbiers marins (Grosholz et Ruiz, 1996 ; Ray, 2005). Le Crabe vert juvénile utilise également des roches et autre substrat dans la zone intertidale (Jensen et al., 2002). Il se trouve généralement au niveau de la marée haute, jusqu’à une profondeur de 5 à 6 m mais peut également se trouver jusqu’à 60 m de profondeur.
Il présente une grande capacité d’adaptation tant au niveau de la température de l’eau (de 0 à 35°C) (Eriksson et Edlund, 1977 ; Hidalgo et al., 2005) que de la salinité (de 4 à 52‰) (Cohen et Carlton, 1995). Un taux supérieur à 20 ‰ de salinité est nécessaire pour le développement larvaire (Colère et al., 1998). Il est également tolérant à des conditions d’anoxie (Legeay et Massabuau, 2000) et survit au moins cinq jours hors de l’eau (Darbyson, 2006). Les études, menées principalement sur les populations européennes et du Sud des États-Unis, sous-estiment sa tolérance à la température du Canada Atlantique et du Nord de la Nouvelle-Écosse et du golfe du Saint-Laurent.
Cette capacité d’adaptation à la salinité et à la température et son importante résistance à la dessiccation sont autant de facteurs facilitant sa dispersion par le trafic maritime.
Découverte à Saint-Pierre et Miquelon et risques associés
À Saint-Pierre et Miquelon, l’espèce a été découverte en 2013. L’échantillonnage d’individus de la mi-juillet à la fin septembre 2014 sur les stations a permis de confirmer l’aire d’implantation de l’espèce. Trois individus ont été capturés dans le Grand étang de Miquelon. La totalité des individus capturés étaient des mâles reproducteurs, de grande taille. A partir de la taille des individus observés, on peut estimer qu’ils sont présents dans les eaux de l’archipel depuis au moins quatre ans (Berrill 1982, Yamada et al., 2005). Des analyses génétiques sont en cours pour permettre de rattacher la population découverte à une « famille » de Crabe vert en fonction de sa provenance, et de définir par quel moyen les individus ont pu arriver dans l’archipel.
Différentes études sur l’impact du Crabe vert montrent que de nombreuses espèces indigènes, naturellement présentes sur les côtes, ou exploitées en aquaculture peuvent être impactées par la présence de cette espèce exotique envahissante (Paille et al. 2006). En fouillant dans le sable à la recherche de proies, le Crabe vert coupe les racines et détruit les herbiers de zostère, milieu protégé abritant de nombreuses espèces mais également constituant une zone de fraie importante (cf. figure ci-dessous).

La mise en place de placettes de suivis dans les herbiers à zostère en baie de Plaisance (Terre-Neuve, Canada) en 1998 et 2012 a permis de mettre en évidence l’impact du Crabe vert dans ce milieu (Com. Pers. Cynthia Mac Kenzy – DFO Nl). Suite à son introduction, le recul des herbiers à zostère et la désertification de ce milieu essentiel à bon nombre d’espèces pour leur alimentation et leur reproduction a été constaté, recul lié au comportement fouisseur du Crabe vert. Cette étude a été confirmée par les travaux menés dans les herbiers de la côte néo-écossaise notamment au sein des lagunes maritimes dans le Parc National de Kejimkujik (Canada).
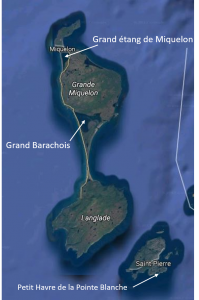
Il représente donc une menace potentielle pour les herbiers à zostère des lagunes du Grand Barachois, du petit Havre de la Pointe Blanche et du Grand étang de Miquelon (cf. carte ci-contre).
Outre ses impacts sur les herbiers à zostères, le Crabe vert exerce une pression de prédation importante sur les mollusques et les crustacés ne dépassant pas sa taille. Selon la littérature scientifique disponible, le Crabe vert peut se nourrir d’organismes appartenant à 104 familles et 158 genres. Opportuniste et nécrophage, il consomme des petits poissons ou des carcasses. Il peut aussi se nourrir de larves de Homard (Homarus americanus), constituant ainsi une menace sur l’économie de cette pêche.
La présence du Crabe vert en grand nombre pourrait ainsi considérablement modifier la biodiversité des eaux de Saint-Pierre et Miquelon et nuire à l’aquaculture comme à la pêche aux coquillages.
Quels moyens de gestion envisager à Saint-Pierre et Miquelon ?
Une surveillance du Crabe vert est mise en place à Saint-Pierre et Miquelon depuis 2013. L’éradication d’une espèce exotique envahissante marine étant impossible, il s’agît donc de limiter son expansion.
La seule méthode efficace connue à ce jour la gestion d’une invasion du Crabe vert une fois détectée sur un site reste de capturer un maximum d’individus. La capture se pratique avec des casiers Fukui (reconnus comme étant les plus efficaces) et consiste dès la détection à intensifier de façon importante les captures.

On peut corréler l’implantation du Crabe vert dans le fond du Grand étang de Miquelon avec l’hydrodynamisme de celui-ci. En effet, la modification de son « goulet » (exutoire sur la mer) par la pose d’un pont prenant ses assises dans le lit même de celui-ci, a ralenti la circulation de la masse d’eau en freinant les échanges d’entrées et de sorties d’eau lors des marées. Si on y ajoute les faibles profondeurs du plan d’eau, le grand étang devient alors une zone tout à fait favorable à l’implantation et à la reproduction du Crabe vert, et donc au développement de ses populations. Cette lagune est pour l’instant la seule où l’on ait détecté le Crabe vert.
Frank Urtizberea, DDTM Saint-Pierre et Miquelon
En savoir plus
-
- Broekhuysen, G.L. 1936. On development, growth and distribution of Carcinides maenas (L.). Néer. Zool. 2 : 257-399.
- Best, K., McKenzie C. H. et Couturier, C. 2017. Reproductive biology of an invasive population of European green crab, Carcinus maenas, in Placentia Bay, Newfoundland. Management of Biological Invasions. 8(2) : 247-255.
-
- Darbyson, E.A. 2006. Local vectors of spread of the green crab (Carcinus maenas) and the clubbed tunicate (Styela clava) in the southern Gulf of St. Lawrence, Canada. Thèse (M.Sc.) Université Dalhousie, département de biologie, Halifax, N.-É.
-
- Dawirs, R.R., C. Pueschel et F. Schorn. Temperature and growth in Carcinus maenas L. (Decapoda: Portunidae) larvae reared in the laboratory from hatching through metamorphosis. J. Exp. Mar. Biol. Ecol. 100 : 47-74.
-
- DeRivera, C.E., N. Gray Hitchcock, S.J. Teck, B.P. Steves, A.H. Hines et G.M. Ruiz. 2006. Larval development rate predicts range expansion of an introduced crab. Mar. Biol. (publication sur Internet) DOI 10.1007/s00227-006-0451-9.
- Duncombe L. G. et Therriault T.W. 2017. Evaluating trapping as a method to control the European green crab, Carcinus maenas, populations at Pipestem Inlet, British Columbia. Management of Biological Invasions. 8(2) : 235-246.
-
- Eriksson, S. et A.-M. Edlund. On the ecological energetics of 0-group Carcinus maenas (L.) from a shallow sandy bottom in Gullmar Fjord, Sweden. J. Exp. Mar. Biol. Ecol. 30 : 233-248.
-
- Pihl, L. 1985. Food selection and consumption of mobile epibenthic fauna in shallow marine areas. Mar. Ecol. Prog. S 22 : 169-179.
-
- Quieroga, H. 1996. Distribution and drift of the crab Carcinus maenas (L.) (Decapoda, Portunidae) larvae over the continental shelf off northern Portugal in April 1991. J. Plankton Res. 18 : 1981-2000.
-
- Quieroga, H., J.D. Costlow et M.H. Moreira. 1997. Vertical migration of the crab Carcinus maenas first zoea in an estuary: Implications for tidal stream transport. Mar. Ecol. Prog. Ser. 149 : 121-132.
-
- Quieroga, H. 1998. Vertical migration and selective tidal stream transport in the megalopa of the crab Carcinus maenas. Hydrobiol. 375/376 : 137-149.
-
- Sharp, G., R. Semple, K. Connolly, R. Blok, D. Audet, D. Cairns et S. Courtenay. Ecological assessment of the Basin Head Lagoon: A proposed Marine Protected Area. Rap. tech. can. sci. halieut. aquat. 2641.
- Zeng, C. et E. Naylor. 1996. Endogenous tidal rhythms of vertical migration in field collected zoea-1 larvae of the shore crab Carcinus maenas: Implications for ebb tide offshore dispersal. Mar. Ecol. Prog. Ser. 132 : 71-82.

