Cette efficacité lui est hélas largement reconnue car très bien identifiée depuis plusieurs années, en particulier dans le nord et l’est de l’hexagone où elle colonise de plus en plus de canaux de navigation et de cours d’eau en connexion. Cela a d’ailleurs amené début février de cette année Voies Navigables de France et l’Office Français de la Biodiversité à lui consacrer presque exclusivement un webinaire d’une demi-journée intitulé Assises nationales “Plantes Exotiques Envahissantes” 2024 : des solutions à long terme, ceci afin d’établir un bilan provisoire des enjeux de gestion de cette espèce.
Ses caractéristiques et capacités sont bien évidemment les facteurs explicatifs de cette apparente facilité de colonisation de divers types de milieux aquatiques d’eau douce, aussi le présent article a-t-il pour objectif de présenter de manière synthétique les informations disponibles sur son écologie.
Il est très largement appuyé sur cette publication récente en libre accès : Elisabeth M. Gross, Hélène Groffier, Cécile Pestelard, Andreas Hussner. 2020. Ecology and Environmental Impact of Myriophyllum heterophyllum, an Aggressive Invader in European Waterways. Diversity 2020, 12, 127. 23 pp
N.B. : Afin de ne pas surcharger la lecture, sauf source d’information ajoutée spécifiquement pour le présent article, les références utilisées sont signalées par les indications numérotées qui figurent dans la publication de 2020.
Comment identifier l'espèce?
Les grandes similitudes des formes végétatives immergées des espèces de Myriophyllum peuvent créer des confusions lors des observations de terrain |17|. En Europe, M. heterophyllum peut en particulier être assez facilement confondu avec M. verticillatum. Un caractère de différenciation est une disposition particulière de certains verticilles montrant des décalages de certaines feuilles. En revanche, l’identification de M. heterophyllum devient beaucoup plus facile lorsque les épis floraux sont émergés : en effet, leur configuration particulière et la présence de stigmates rouges à la base des feuilles rendent ces épis très reconnaissables (Figure 1).

Figure 1 : Caractéristiques morphologiques de Myriophyllum heterophyllum. (a-d) épis floraux avec bractées et stigmates rouges (e, f) section de pousse avec détail des feuilles légèrement décalées à l’intérieur d’un verticille (Photos (a) A. Hussner, (b-e) C. Pestelard, (f) N. Dubost).
Lorsqu’une variation du niveau des eaux conduit à l’assèchement des biotopes où la plante est présente, une forme terrestre plus réduite avec des pousses de petite taille peut subsister durant apparemment plusieurs semaines (Figure 2), une forme de résistance pouvant permettre le maintien de l’espèce dans le site |2,43|. Cette forme peut également se développer dans les déchets de plantes déposées sur les berges des canaux après arrachage ou moisson (Hélène Groffier, comm. pers.).

Figure 2 : Formes de croissance terrestre de Myriophyllum heterophyllum. Photo A. Hussner.
N.B. : Compléments d’illustration : une fiche d’identification est disponible sur le portail « La biodiversité en Wallonie ». Comme aide complémentaire à cette identification, elle comporte des photos d’autres espèces de Myriophyllum. C’est également le cas de la fiche d’illustration du genre disponible sur le site Q-bank. Enfin, page 189 dans l’article de Le Gloanec et al. (2019) se trouvent des photos d’organes florifères et de fruits de l’espèce.
Les individus de l’espèce peuvent être hermaphrodites ou monoïques. En Europe, aucune production de graines viables n’a été constatée jusqu’à présent |2| , bien que des fruits aient été observés dans quelques inflorescences dans un site du département de la Marne (Le Gloanec et al., 2019). Elle s’y reproduirait donc uniquement par voie végétative, c’est-à-dire par le développement de ses tiges feuillées et par la dispersion de fragments de ces tiges fragiles et cassant facilement. Chaque fragment, produit par auto-fragmentation (fragmentation auto-induite) et/ou allo-fragmentation (fragmentation causée par une perturbation physique) peut alors constituer une bouture potentielle. La régénération peut se produire à partir de très petits fragments (<1 cm), voire même depuis des feuilles isolées |49|, mais elle est plus lente que ce qui a pu être observé pour d’autres plantes submergées comme Myriophyllum spicatum (une espèce européenne) ou des espèces exotiques comme Elodea canadensis ou Hydrilla verticillata |79,80|.
Bien que le nombre de fragments de pousses produits par M. heterophyllum soit plutôt faible, environ 60 % d’entre eux possèdent déjà des racines (Elisabeth Maria Gross, observations personnelles ; |45|) et leur dérive dans les milieux (courants, vents) facilite leur dispersion et au final l’extension potentielle de l’espèce. La tolérance élevée de ces fragments à la dessiccation |84|, indiquant qu’une perte d’eau d’environ 80 % n’entraînait pas un dépérissement général |85|, pourrait encore faciliter la réussite de cette dispersion |86|.
Ses colonisations rapides, observées aussi bien en Amérique du Nord |9| qu’en Europe |46|, et fréquemment dans des canaux créés pour la navigation fluviale, comme c’est actuellement le cas dans le Nord et l’Est de l’hexagone, peuvent ainsi être la conséquence des passages réguliers dans ces milieux de péniches et de bateaux de plaisance, facilitant sa dissémination.
Pour mémoire, les analyses génétiques actuellement disponibles permettent de différencier les espèces et les hybrides du genre Myriophyllum (voir |35,36,37,38|).
Eléments d'écologie
Espèce à feuilles persistantes, Myriophyllum heterophyllum peut être présente toute l’année. Observée en forte concurrence avec diverses autres plantes immergées indigènes, dont M. verticillatum |32|, cette persistance dans les milieux lui donne un net avantage compétitif. En effet, même si les espèces à feuilles persistantes présentent des taux de croissance généralement plus faibles que les espèces saisonnières, cette persistance peut compenser ce taux de croissance plus faible pendant la principale saison de croissance |65,66|. De plus, ses fragments dispersés dans de nouvelles zones non végétalisées entre fin d’automne et début du printemps ne sont pas limités dans leur processus de colonisation par la présence des plantes indigènes |67|.
Elle se développe généralement dans des eaux stagnantes ou présentant de faibles vitesses de courant (plans d’eau de nature diverses, canaux et cours d’eau, Figure 3) |2,12,25,29,32,45|, jusqu’à des profondeurs maximales d’environ 10 m |2|. Comme diverses autres plantes aquatiques immergées, ses besoins en lumière sont relativement faibles ce qui explique sa capacité à se développer à des profondeurs importantes dans les eaux transparentes de certains plans d’eau et dans des eaux turbides des canaux à de moindres profondeurs.

Figure 3 : Milieux colonisés par Myriophyllum heterophyllum. (a,c) canaux de navigation dans le nord-est de la France (Photos C. Pestelard) ; (b) étang sur le campus de l’Université de Düsseldorf, Allemagne (Photo A. Hussner).
Les sédiments colonisés sont dans la plupart des cas de textures fines comme des limons, du sable ou des graviers, comportant fréquemment des teneurs élevées en azote.
Les températures optimales de l’espèce semblent se situer entre 20 et 25 °C et ses développements les plus importants se trouvent généralement à des profondeurs de 1 à 2 mètres. Le fait que, contrairement à nombre d’espèces de plantes immergées, elle soit persistante lui donne un avantage compétitif en période printanière pour occuper plus rapidement les biotopes disponibles.
Myriophyllum heterophyllum présente une assez large amplitude en matière de qualité des eaux, conductivité, pH ou alcalinité, avec par exemple des valeurs de pH assez élevées, en moyenne 8,2-8,3, dans des secteurs très fortement colonisés par l’espèce dans les canaux du nord-est de la France, ou des gammes d’alcalinité de faible à très élevée. Les différents travaux de recherche menés sur ce sujet conduisent à des interprétations diverses qui pourraient correspondre à la présence de différentes lignées génétiques des populations étudiées possédant des capacités d’adaptation particulières |8|.
Dans des conditions de pH ne dépassant pas 7,5 |46,56|, le dioxyde de carbone (CO2) est la source de carbone utilisée par M. heterophyllum pour la photosynthèse. Des recherches de laboratoire sur l’impact de la disponibilité du carbone et des nutriments sur la croissance de cette espèce parmi d’autres ont montré qu’elle présentait l’un des taux de croissance relatifs les plus élevés lorsqu’elle était cultivée dans des sédiments riches en nutriments sous une forte disponibilité de CO2 |61|. Elle peut également utiliser le HCO3 comme source de carbone inorganique, ce qui peut lui permettre d’élargir sa niche écologique dans des milieux au pH plus élevé, comme cela a été observé récemment dans le nord-est de la France dans des eaux avec des pH d’environ 8,0-8,5. Cette possibilité à elle seule n’est cependant pas un avantage compétitif suffisant pour expliquer sa dominance dans les biotopes car d’autres plantes immergées la possèdent également, dont une des espèces indigènes de Myriophyllum, M. spicatum |50|.
Besoins en nutriments
Pour ce qui concerne ses besoins en nutriments, là encore M. heterophyllum semble pouvoir se développer dans des eaux présentant une assez large gamme de conditions nutritives, d’oligotrophes à eutrophes (teneurs en azote de ~0,3 à ~3 mg/L NO3-N, en phosphore total pouvant atteindre 30-40 μg/L) |46,49,56|). Les nutriments des sédiments colonisés par la plante sont également des ressources nutritives qu’elle utilise.
Pour les plantes aquatiques immergées, l’importance de la disponibilité globale de nutriments dans un site donné (eaux et sédiments) est un des facteurs de production de leur biomasse et de leurs capacités de stockage d’azote et de phosphore dans leurs tissus. Pour de nombreuses espèces, ces teneurs en azote et en phosphore sont généralement de l’ordre respectivement de 1,5 % et 0,5 % des matières sèches.
Pour M. heterophyllum, dans des conditions expérimentales, les teneurs en azote de ses feuilles étaient d’environ 2,5-3 % |58|. Dans les recherches en cours sur M. heterophyllum dans le Port de Saint-Jean-de-Losne (21), réalisé par le laboratoire LIEC de l’Université de Lorraine (Elisabeth Maria Gross, comm. pers.), les teneurs en azote mesurées étaient variables mais très élevées, 3,2 et 5,8% de la masse sèche, très supérieures aux besoins de la plante. Les teneurs en phosphore étaient variables de 0,25 à 0,6 %.
La variabilité des teneurs en phosphore de la plante a été également observée dans les travaux de Kimball (1981), avec de teneurs dans la plante entière de 0,32 à 1,05 %. Il a également noté d’autres variations dans des analyses des apex des tiges, certaines saisonnières, avec des maximas au printemps et en début d’automne (valeurs de 1,7 à 5,2 et moyenne de 2,4 %), des teneurs plus faibles durant la saison de croissance (valeurs de 1,3 à 1,9 et moyenne de 1,7 %) et des variations au sein de la plante elle-même avec des teneurs plus élevées dans les apex et les tiges émergées.
Production de biomasse
A l’instar d’autres espèces de plantes aquatiques immergées, dans les biotopes favorables (profondeurs peu importantes, absence d’ombrage, absence ou faiblesse de courant), M. heterophyllum peut se développer en herbiers très denses, occupant tout le volume disponible du fond jusqu’en surface, pouvant éliminer toutes les autres plantes. Dans de telles conditions d’occupation les biomasses végétales, mesurées en matières sèches, peuvent dépasser 1 kg par mètre carré.
Les données de biomasses de M. heterophyllum disponibles dans la littérature consultée sont relativement variables. Par exemple les valeurs maximales mesurées dans le cadre de sa thèse sur le lac Winnipesaukee (New Hampshire) par Kimball (1981) étaient de l’ordre de 250 g/m². Celles issues de prélèvements dans des plans d’eau urbains aux eaux moyennement riches en nutriments proches de Düsseldorf étaient d’environ 350 g/m² |49|). Dans d’autres recherches menées dans les environs de Leipzig, sur le canal Elster- Saale et différents plans d’eau de gravières aux profondeurs ne dépassant pas 2,5 m, les valeurs de biomasse obtenues étaient nettement plus élevées, bien que restant très variables selon les sites, s’étendant de près de 500 g à plus de 1300 g/m2, dont environ 1100 g/m² dans le canal. La valeur moyenne de ces mesures était de 965 g/m2 |46|. L’espèce est donc capable de production de biomasse parmi les plus importantes connues pour les plantes aquatiques immergées d’eau douce.
Dans le port de Saint-Jean-de-Losne, les biomasses sèches mesurées durant le premier semestre 2021 dans des zones fortement colonisées étaient très élevées, dépassant 1000 g/m² (Elisabeth Maria Gross, comm. pers.). Par la suite, les interventions de faucardage et de moisson réalisées régulièrement ont limité les productions des plantes, qui n’ont plus dépassé 300 à 500 g/m².
Un élément extrêmement important vis-à-vis des interventions de gestion des plantes aquatiques immergées est leur très importante teneur en eau. Contrairement aux plantes émergées ou terrestres, les parties végétatives de ces plantes immergées, largement portées dans leurs biotopes, ne comportent que très peu de tissus de soutien, aussi leurs teneurs maximales en matières sèches ne dépassent généralement pas 10 %. Par exemple, les mesures réalisées sur M. heterophyllum dans le cadre des travaux en cours de l’Université de Lorraine donnent des valeurs de 6 à 8 % (Elisabeth Maria Gross, comm. pers.) et celles des recherches menées vers Leipzig montraient des valeurs moins variables, entre environ 7,7 et 8 % |46|. En prenant comme base de calcul cette valeur de 8 % en matières sèches et la valeur maximale de biomasse mesurée pour cette plante, soit 1330 g/m² |46|, la biomasse fraîche correspondante est d’environ 16,6 kg/m². Ce qui, ramené à l’hectare, donne une biomasse fraîche dépassant 160 tonnes qui doit être extraite si une intervention est nécessaire pour dégager le site colonisé…
Communautés végétales
En lien avec des grandes capacités d’adaptations à diverses qualités de milieux, Myriophyllum heterophyllum a été observé dans une large gamme d’habitats aquatiques européens |46,50,64| et donc en compagnie de nombreuses plantes indigènes, certaines colonisant plutôt des zones riveraines peu profondes, comme par exemple Pilularia globulifera, Eleocharis acicularis ou Juncus bulbosus, d’autres pouvant s’installer plus en profondeur, comme des espèces de Potamogeton, P. polygonifolius, P. lucens ou P. natans, ou de Myriophyllum, comme M. verticillatum |32| (avec qui elle peut être confondue, comme nous l’avons déjà indiqué) ou M. spicatum. Dans les canaux du nord-est de l’hexagone, l’espèce a également été observée associée à des espèces exotiques comme Elodea nuttallii ou avec Cabomba caroliniana, comme c’est actuellement le cas dans le port d’Auxonne (21) (Hélène Groffier, comm. pers.).
Les analyses phytosociologiques des communautés végétales où elle se retrouve donnent des résultats assez diversifiés, illustrant encore l’adaptabilité de l’espèce. A la suite des travaux menés dans les plans d’eau des environs de Leipzig, le fait que M. heterophyllum soit presque toujours en compagnie de Juncus bulbosus ont conduit à proposer une dénomination « Myriophyllo heterophylii – Juncetum bulbosi » |46|. Les espèces dominantes dans les relevés de végétation du canal proche de Leipzig étaient M. heterophyllum puis Potamogeton lucens, amenant à une proposition de classement dans le Potametum lucentis (Hueck 1931) |64|.
Dans son mémoire de stage récent (Bertino, 2021) portant sur une étude de l’écologie de M. heterophyllum et de son impact sur les végétations aquatiques de la Haute Vallée de la Somme, Marylou Bertino indique que l’espèce était présente dans 55 des 72 relevés réalisés, couvrant toutes les gammes d’abondance, de très rare à tout à fait dominant (couverture totale). L’analyse phytosociologique établie à partir de ces relevés montre que l’ensemble appartient à la classe des Potametea pectinati, avec trois principales alliances, 35 relevés appartenant au Potamion pectinati (W. Koch 1926) Libbert 1931, 17 au Batrachion fluitantis Neuhäusl 1959, et 9 relevés au Nymphaeion-albae Oberd. 1957. Les première et troisième de ces alliances correspondent à des herbiers des eaux stagnantes ou de faible courant, moyennement profondes, méso-eutrophes à eutrophes, la deuxième, moins présente mais non négligeable, indique plutôt une végétation adaptée aux eaux courantes. Rien de surprenant dans le contexte d’un cours d’eau de plaine, avec 22 espèces comme richesse maximale des relevés et des abondances élevées de M. heterophyllum et de M. spicatum et Nuphar lutea. Le taux de recouvrement de M. heterophyllum dans les stations étudiées semble jouer un rôle important sur la diversité d’espèces végétales présentes : des taux de recouvrements de l’espèce supérieurs à 50 % correspondent à une plus faible richesse de la communauté présente.
Répartition
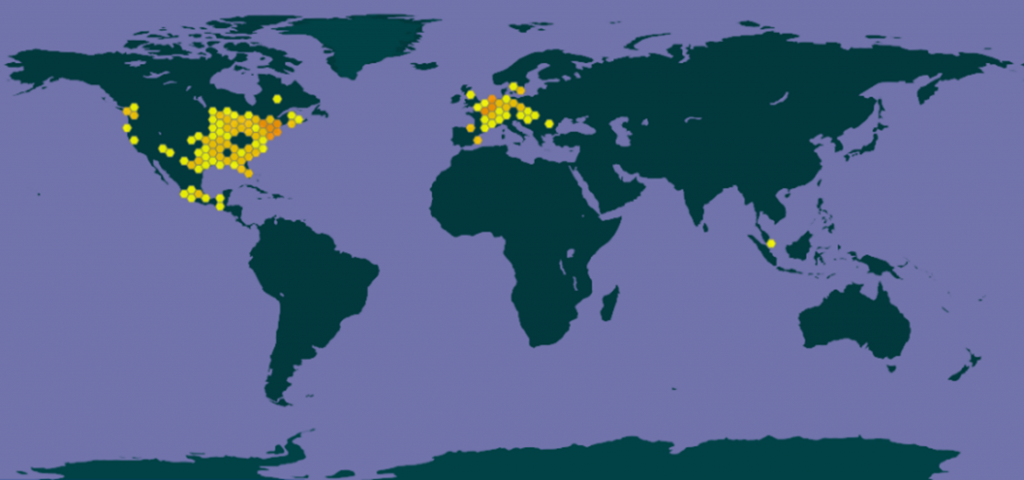
– dans le monde (voir carte GBIF)
L’aire naturelle d’origine de Myriophyllum heterophyllum semble être une partie du continent nord-américain, de la Floride au sud à l’Ontario au nord, et vers l’ouest jusqu’au Missouri et au Texas |6|.
L’espèce n’est pas considérée comme indigène dans le nord-est ou l’ouest des Etats-Unis où elle a été dispersée depuis les années 1980 dans plusieurs états comme la Nouvelle-Angleterre, la Californie, l’Oregon et l’Etat de Washington) |7,8|.
L’espèce est considérée comme indigène dans l’Est du Canada (Nouveau-Brunswick, Île-du-Prince-Édouard, Québec et Ontario) et introduite dans l’ouest en Colombie-Britannique |11|. L’espèce est également considérée comme indigène au Guatemala et au Mexique |14| et comme exotique mais « naturalisée » dans le sud de la Chine |15|.
– en Europe (voir carte GBIF)
En Europe, M. heterophyllum a été observée depuis des durées variables en Allemagne, Autriche, Belgique, Espagne, France, Hongrie, Pays- Bas, Suisse |1,2| et plus récemment, en 2016, en Croatie |16|. Les premières découvertes dans des plans d’eau naturels datent des années 1940, en Allemagne, Autriche et Suisse |17|. Cependant, il ne semble pas que ces installations de l’espèce à partir des États-Unis soient en lien avec la Seconde Guerre mondiale car elle pourrait avoir été importée antérieurement et volontairement |17|.
Actuellement, la situation dans ces pays européens est très variable et en évolution apparemment rapide dans certains cas.
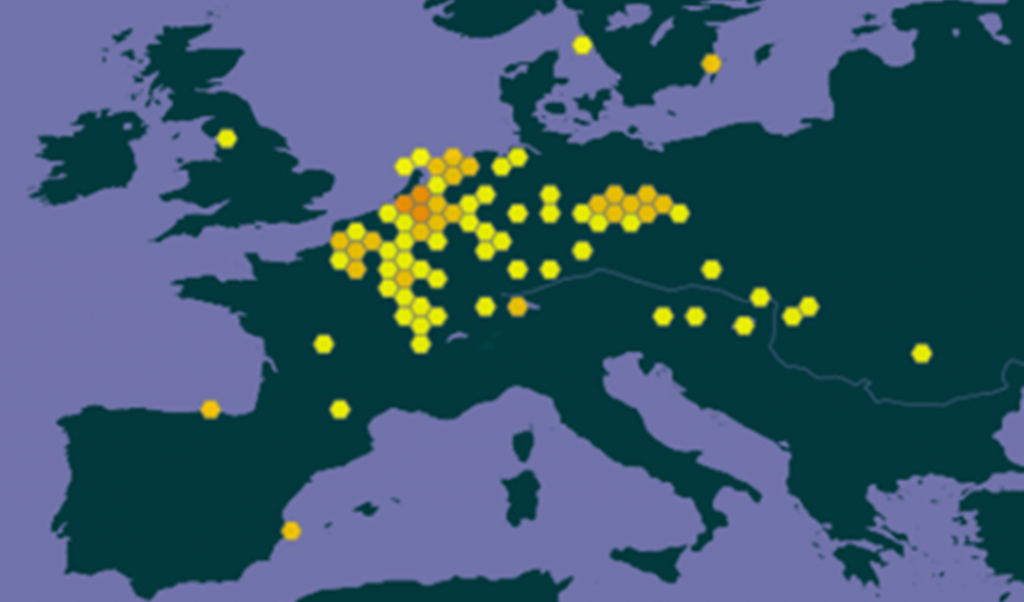
Le bilan établi en 2020 rappelait entre autres difficultés celle de l’identification exacte de l’espèce et citait l’exemple de la Croatie où la découverte par hasard de l’espèce dans un site a déclenché des recherches dans les milieux proches ayant permis de la repérer dans de nombreuses autres stations, sans information sur les dates effectives de son installation |16|.
En Allemagne, ses populations les plus anciennes et les plus répandues se trouvent dans l’est de l’Allemagne, principalement dans des canaux tels que le canal Elster-Saale |46, 64|. D’autres sites ont été colonisés à la fin des années 70 en Rhénanie du Nord-Westphalie dans la région de de Düsseldorf |32|. Depuis cette époque, des découvertes éparses ont été faites dans au moins quatre autres États fédéraux |31| et d’autres sites colonisés dans le sud du land de Hesse sont par exemple signalés par Nesemann (2021).
Aux Pays-Bas, après un premier signalement en 1999, l’espèce a été observée dans plusieurs canaux et ports à partir de 2007 et, depuis 2016, elle est présente dans tout le sud-est et le centre du pays |27| avec une autre extension vers le nord et l’ouest |28|. En Belgique, l’espèce a été trouvée à partir de 1996 dans des canaux près de Namur |12|) et d’Anvers en 2006 |25|.
Détectée dans quelques sites en Espagne à partir de 1987, elle semble se maintenir dans quelques plans d’eau semi-naturels du nord et de l’est |22,24|. Cette présence en Espagne a conduit à une analyse des risques d’introduction au Portugal, où elle n’est pas encore observée en milieu naturel, proposant la mise en en place d’efforts particuliers de prévention et de suivi la concernant (Diogo, 2023).
– dans l’hexagone
La première observation formelle publiée de M. heterophyllum a été réalisée en juillet 2011 dans un étang du département de la Haute- Vienne |12|. Des observations ponctuelles antérieures dans les Pyrénées Atlantiques, les Landes et la Somme ont été citées sans autre précision de date ou de lieu |33|.
En juin 2015, suite à une information du CBN de Bailleul sur une importante colonisation d’une gravière observée en août 2014 dans la commune de Contres (Somme) identifiant M. heterophyllum, un article a été mis en ligne par le Centre de Ressources EEE dans sa rubrique « A surveiller de près ».
A la suite de contacts avec le département de la Somme faisant état depuis 2011 de la colonisation croissante par M. heterophyllum du cours du fleuve et de ses canaux, un retour d’expérience faisant état des interventions menées de 2011 à 2017 a été corédigé et mis en ligne début 2018. Il comporte des cartes de localisation des interventions menées en 2016 et 2017 sur les populations les plus importantes.
Une courte note du CBNBP de 2019 signale sa présence dans les départements des Ardennes, de la Marne et de la Haute-Marne principalement dans des canaux de navigation |34|.
Depuis environ 2014, la direction territoriale nord-est de VNF a été progressivement confrontée à des colonisations partielles ou totales rapidement étendues à de nombreux biefs des canaux de navigation de son secteur par une plante aquatique qui s’est avérée être M. heterophyllum après son identification formelle en 2018 par Elisabeth Maria Gross de l’Université de Lorraine.
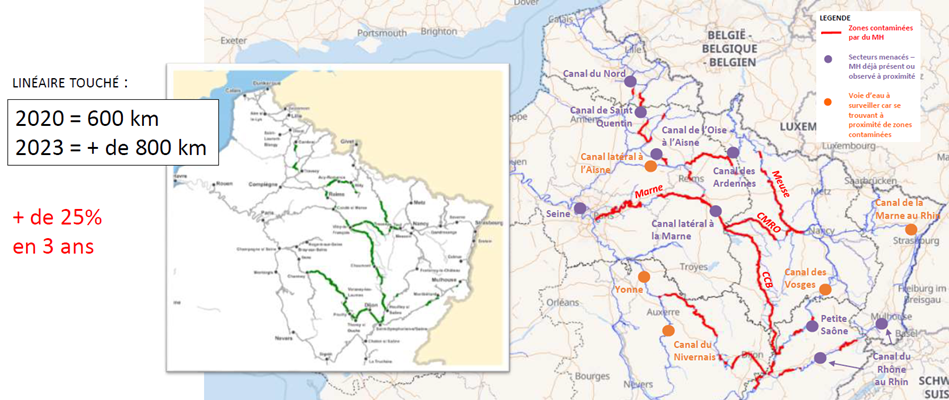
Les cartes ci-après, établies par VNF, présentent les linéaires colonisés en 2020 et 2023. Les deux cartes de 2020 et 2023 faisaient partie des informations présentées lors du webinaire organisé par VNF et l’OFB début février 2024. Une carte de 2019 figure dans la publication de 2020 (page 5).
En 2017, à notre connaissance, le linéaire colonisé était de l’ordre de 120 km, il s’est très rapidement accru et son augmentation de plus de 25 % entre 2020 (600 km) et 2023 (plus de 800 km) illustre parfaitement la capacité de dispersion et de colonisation de l’espèce et permet également de mieux percevoir les enjeux de sa gestion à cette échelle de territoire.
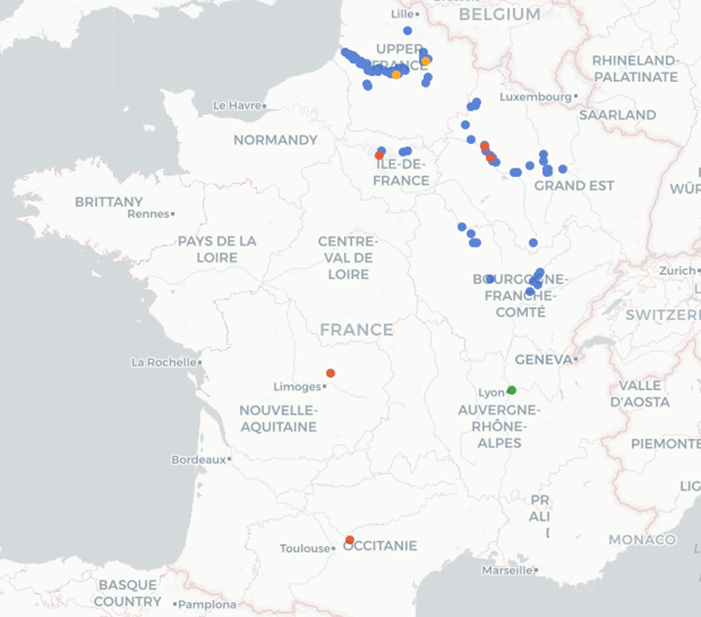
L’espèce est référencée sur le site de l’Inventaire national du patrimoine naturel (INPN).
Une consultation du Portail français d’accès aux données d’observation sur les espèces « OpenObs » permet de présenter la carte de répartition des 377 observations recensées dans la base, avec les compléments d’informations suivants :
– l’un sur les périodes de ces observations, soit 217 durant la décennie 2010 et 220 pour la décennie 2020 en cours,
– l’autre portant sur la répartition régionale de ces observations, soit 319 dans la région Hauts de France, 33 en région Grand Est, 15 en région Franche-Comté et 2 en région Auvergne-Rhône-Alpes… Il est très probable que ce recueil d’observations va s’accroitre rapidement dans le futur.
– en région Franche-Comté
A la suite de la publication sur M. heterophyllum, des prospections ciblées du CBNFC-ORI mises en place durant les étés 2020 et 2021 ont permis de repérer l’espèce dans quelques sites de la Saône, ce qui a conduit à déclencher en 2022 la réalisation d’un bilan stationnel pour préciser la répartition de l’espèce et caractériser ses habitats et ses impacts.
Un rapport intermédiaire est disponible (Vuillemenot, 2022) mais un rapport final sera prochainement établi après les compléments d’inventaire de 2023. Les informations recueillies en particulier sur les sites de jonctions entre le réseau de canaux de navigation et les cours d’eau montrent déjà l’importance de la colonisation actuelle dans cette partie de l’hexagone.
Parmi les perspectives stratégiques figurant dans ce document se trouvent une vérification de l’identité du myriophylle observé, rendue indispensable par la présence dans la région de M. verticillatum, cette espèce indigène morphologiquement très proche, classée NT « quasi menacée » dans les listes rouges régionales de la flore vasculaire de Bourgogne et de Franche-Comté.
Commentaires
Comme cela était précisé, cet article avait pour objectif de présenter un premier bilan des connaissances disponibles sur l’écologie de l’espèce. Il s’est largement inspiré de la publication de Gross et al. (2020), conçue comme une revue sur les connaissances sur l’écologie, les conditions et enjeux de sa dispersion dans l’hexagone et les possibilités de la gestion de l’espèce dans les milieux colonisés.
Pour le compléter, quelques éléments d’information ou de précision ont été recherchés dans certaines des publications référencées dans cette revue.
Par ailleurs, une récente investigation en ligne pour accéder à d’autres publications pouvant compléter les données sur l’écologie de l’espèce n’a donné que peu de résultats directement utilisables. Il est cependant à noter que la publication de Kimball (1981) présentant diverses données sur M. heterophyllum, dont des teneurs en nutriments et des estimations de biomasse, porte sur des populations colonisant un lac du New Hampshire, un des états de la Nouvelle Angleterre au Nord Est des États Unis où l’espèce est considérée comme exotique envahissante, comme les recherches menées en Europe. Elle peut ainsi contribuer à alimenter les connaissances écologiques sur cette espèce dans de nouveaux contextes environnementaux hors de sa région d’origine.
Le webinaire VNF OFB de février a surtout permis de présenter les enjeux de cette très importante et rapide colonisation, les difficultés rencontrées et les moyens mis en œuvre pour gérer la plante. Les recherches actuellement menées sur l’écologie de l’espèce dans le cadre d’une thèse de l’Université de Lorraine (laboratoire LIEC) portant en grande partie sur des suivis d’interventions de gestion dans des sites tels que le port de Saint-Jean-de-Losne (21) ont été citées à diverses reprises par les intervenants. Étant toujours en cours, elles n’ont cependant pas fait l’objet d’une présentation spécifique lors de cette manifestation ouverte à tous les publics. De premiers résultats ont toutefois pu être partagés en mars de cette année lors de la dernière réunion en date du réseau d’expertise scientifique et technique du Centre de ressources EEE, permettant d’ouvrir de nouveaux échanges sur cette espèce entre chercheurs et gestionnaires.
Ces recherches vont faire l’objet de publications ultérieures complétant les connaissances sur l’écologie de l’espèce. Elles vont également pouvoir contribuer à une meilleure évaluation des efficacités des techniques et des protocoles de gestion mis en place depuis quelques années par les différents organismes gestionnaires confrontés à cette colonisation végétale toujours dynamique. L’ensemble des informations que ces publications fourniront pourront ensuite aider le CDR EEE à poursuivre la communication engagée sur cette espèce en produisant des articles complémentaires.
Rédaction : Alain Dutartre (expert indépendant)
Relectures : Hélène Groffier (Université de Lorraine), Elisabeth Maria Gross (Université de Lorraine)
Références
Bertino M., 2021. Étude de l’écologie du Myriophylle hétérophylle (Myriophyllum heterophyllum Michx., 1803) et son impact sur les végétations aquatiques de la Haute Vallée de la Somme. Université Aix Marseille, mémoire de stage, année 2020-2021. Mention : Biodiversité, écologie et évolution (BEE), 34 pp.
Kimball K. D. 1981. The ecology of a submersed macrophyte, Myriophyllum alterniflrorum. Competition for nutrients with phytoplancton and seasonal changes in tissue mineral. University of New Hampshire. Doctoral Dissertation, 1308. 140 pp.
Vuillemenot M., 2022. Bilan stationnel du myriophylle hétérophylle (Myriophyllum heterophyllum Michx.) en Franche-Comté ; bilan intermédiaire – 2022. Conservatoire botanique national de Franche-Comté – Observatoire régional des Invertébrés, 14 p. + annexe.
Pour mémoire : quelques rappels sur l’espèce :
- les classements et statuts donnés à l’espèce
Listes OEPP : https://gd.eppo.int/taxon/MYPHE/documents
OEPP : analyse de risque : https://gd.eppo.int/download/doc/377_pra_exp_MYPHE.pdf
Liste des espèces exotiques envahissantes préoccupantes pour l’Union Européenne (Règlement 1143/2014)
- les informations déjà transmises par le CDR sur l’espèce
Info sur Somme juin 2015 : http://especes-exotiques-envahissantes.fr/le-myriophylle-a-feuilles-diverses-myriophyllum-heterophyllum/
REX / Gestion du Myriophylle hétérophylle sur la Somme et ses canaux (janvier 2018) : http://www.especes-exotiques-envahissantes.fr/wp-content/uploads/2018/03/rex_myriophylle_somme_vf.pdf
Lettre d’information Numéro 13 – Janvier/Février 2021
A surveiller de près ! Connaissez-vous le Myriophylle hétérophylle ?
Alerte et appel à contribution pour obtenir des informations sur l’espèce : fiche explicative.
