Le contrôle biologique des EEE ?
Le contrôle biologique est une des méthodes de régulation des EEE de plus en plus utilisée dans le monde. Il a été particulièrement mis en œuvre depuis des décennies dans certains pays très fortement confrontés aux invasions biologiques, comme l’Afrique du Sud, la Nouvelle-Zélande ou l’Australie. Encore peu développé en Europe, il commence cependant à y être envisagé pour certaines EEE végétales ayant déjà fait l’objet de recherches préalables dans ces pays.
Les avantages potentiels et les limites de ce recours à un organisme vivant comme agent régulateur d’une autre espèce sont maintenant assez bien connus. Par ailleurs, les évaluations récentes sur les coûts des dommages et des interventions de gestion nécessaires pour gérer les EEE (voir par exemple l’article du Centre de ressources : Les coûts économiques des invasions biologiques : un fardeau pour la société) et les perspectives d’augmentation de ces dépenses en lien avec le changement climatique conduisent des réflexions croissantes sur l’intérêt de la mise en œuvre de ce mode de gestion.
Un cas particulier : une fougère très colonisatrice
Depuis 2014, le Centre de ressources a mis à en ligne divers articles présentant des recherches en cours et leurs résultats, dont certaines issues de travaux menés en Afrique du Sud (voir références en fin d’article).
Dans les EEE ciblées par ces travaux se trouve la fougère Azolla filiculoides, bien connue du public en métropole pour certaines de ces proliférations en plans d’eau ou en cours d’eau lents très visibles par la couleur rouge de ses frondes mâtures. Cette petite plante flottante arrive à recouvrir très rapidement les milieux aquatiques colonisés, pouvant y créer de fortes modifications de qualité des eaux et des dommages importants pour la flore et la faune aquatiques.
D’origine américaine, cette petite fougère a été largement dispersée sur la planète depuis la fin du XIXème siècle. Elle a été introduite en Europe, en Afrique, en Chine, au Japon, en Nouvelle-Zélande, en Australie, dans les Caraïbes et à Hawaii (Lumpkin & Plucknett, 1980). Ces introductions peuvent être anciennes : par exemple, en métropole, les premières observations connues datent de 1880 (Roze, 1983).
|
Une introduction bordelaise pour Azolla filiculoides ? Dans sa publication, Roze (1883), cite « M. Caille, jardinier en chef du Jardin botanique de Bordeaux, en cultivant avec succès des échantillons vivants des A. caroliniana et filiculoides… » et ajoute « Le climat de Bordeaux paraît, du reste, assez bien convenir à ces deux espèces américaines, car quelques poignées de la première en 1879, et de la seconde en 1880, jetées çà et là dans les fossés des marais de cette ville, ont donné naissance à une légion innombrable de ces plantes, qui ont envahi presque tous les fossés, mares et étangs du département de la Gironde ; les deux espèces commencent même à être signalées sur les confins des départements limitrophes, et leur multiplication, surtout celle de l’A. filiculoides, en de certains endroits est si rapide, que les Lemna, l’Hydrocharis, le Salvinia natans lui-même, sont menacés d’y disparaître. » Comme quoi « quelques poignées » peuvent suffire à coloniser un continent… |
Elle est actuellement signalée en Europe comme EEE dans de très nombreux pays dont la France. En Grande-Bretagne, une observation datant de 1883 identifiant une autre espèce, Azolla caroliniana, a été ultérieurement considérée comme erronée car seule A. filiculoides a depuis été observée sur ce territoire (Odell, 1883 in Reeder et al., 2018).
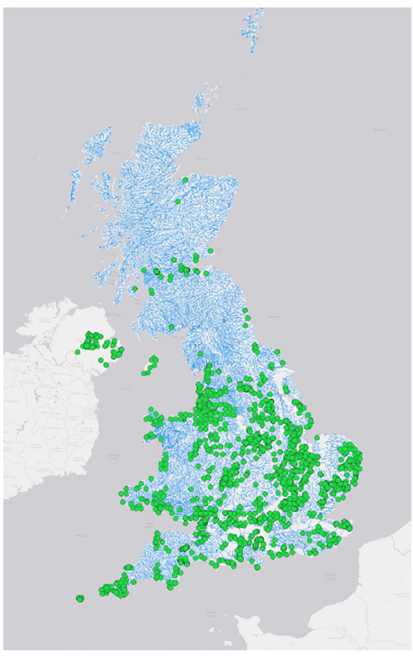
Selon Pratt et al. (2022), elle est largement répandue dans les régions du sud et du centre de la Grande-Bretagne, beaucoup moins dans le nord et en Écosse (Figure 1). En tant que plante exotique envahissante, elle est inscrite à l’annexe 9 du Wildlife and Countryside Act (1981) et a été interdite à la vente en Angleterre en 2014 (legislation.gov.uk, 2014).
Un adversaire de taille

Si cette petite plante est maintenant bien identifiée comme une espèce dont le contrôle biologique est envisageable, c’est qu’elle peut être confrontée en milieu naturel à un adversaire efficace, un charançon de la famille des Curculionidae (Coléoptère), Stenopelmus rufinasus, maintenant connu pour la spécificité de sa consommation.
Ce petit charançon peut développer plusieurs générations durant la période estivale. Les adultes d’environ 2 mm de longueur et 1 mm de largeur ont une durée de vie de moins de deux mois. Les femelles peuvent pondre plus de 300 œufs et le cycle des stades immatures dure environ 20 jours. Plusieurs pontes peuvent être insérées dans la même fronde de la plante et les larves d’une taille pouvant atteindre 4 mm de longueur sont des mineuses qui consomment la fougère (Richerson & Grigarick, 1967).
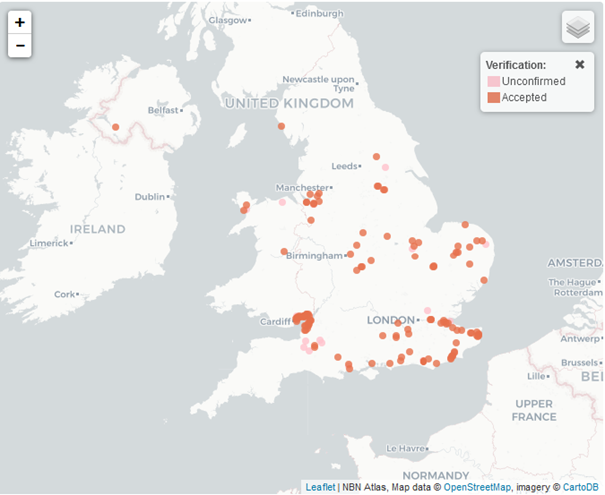
Il est possible que son introduction sur le continent européen depuis l’Amérique se soit faite comme passager clandestin sur A. filiculoides (Janson, 1921). Notons qu’en métropole, sa première observation date de 1898 (Bedel, 1901), près d’une vingtaine d’années après celle de la fougère. Au Royaume-Uni, S. rufinasus est indiqué par Renals (2014) comme ayant été accidentellement introduit lors d’importations de plantes de bassin. Sa répartition actuelle (Figure 2) peut également être la conséquence des introductions commerciales destinées à réduire certaines proliférations d’A. filiculoides, réalisées depuis plusieurs années, à la suite de travaux engagés par le CABI sur ce charançon.
Contrôle biologique de A. filiculoides par S. rufinasus

De premières expérimentations ont eu lieu en Afrique du Sud. Après l’introduction d’A. filiculoides en 1948 sur le territoire, l’espèce a été largement dispersée, colonisant de nombreux plans d’eau. Les dommages causés ont conduit à l’introduction en 1995 de S. rufinasus, collecté en Floride, pour des tests de gamme d’hôtes en laboratoire. Ces travaux ont montré qu’A. filiculoides était l’hôte préféré de S. rufinasus (Hill et al., 2008). A la suite de ces recherches, cinq ans après la libération du charançon en milieu naturel en 1997, il a été constaté que sa présence avait permis le contrôle A. filiculoides, qui ne constituait alors plus une menace pour les milieux aquatiques (McConnachie et al., 2003 et 2004). (voir aussi)
Dans le contexte de la démarche générale menée en Grande-Bretagne depuis le début des années 2000 – particulièrement sous l’égide du CABI (Centre for Agricultural Bioscience International), sur les potentialités de recours au contrôle biologique de diverses plantes exotiques envahissantes des milieux aquatiques – le projet européen RINSE (2011-2014) a comporté des expérimentations de ce mode de contrôle. Ce projet « Réduire l’impact des espèces exotiques envahissantes en Europe« , rassemblant neuf partenaires en France, Angleterre, Belgique et Pays-Bas, cherchait à développer de nouvelles méthodes de gestion sur diverses espèces de plantes.
Lors de ce programme, 15 sites expérimentaux ont ainsi été retenus, allant de très petits plans d’eau (1 m²) à des étangs de plusieurs hectares pour tester le contrôle biologique d’A. filiculoides. Les résultats obtenus ont confirmé l’efficacité de S. rufinasus dans ce contrôle puisque dans la quasi-totalité des sites testés, la disparition d’A. filiculoides a été constatée en 6 à 18 semaines (voir le retour d’expérience réalisé à ce sujet).
Dans les années qui ont suivi, des expérimentations menées par le CABI ont été poursuivies et des tests réalisés en conditions semi-contrôlées (cages en extérieur) de 2004 à 2006 ont permis de montrer que les charançons exerçaient une pression de consommation très visible et donc une réduction nette de la colonisation par la fougère, même à des densités peu importantes (100 individus par m²). Une densité de 400 individus par m² permettait la disparition de la plante dans le mois suivant l’introduction (Reeder et al., 2018).
L’élevage, puis la production en masse de S. rufinasus engagée par le CABI, avec une augmentation de la production en 2010, a permis depuis d’expédier des charançons dans différents sites : selon Pratt et al. (2022), la moyenne 2011-2020 de ces envois est de l’ordre de 43 000 individus (écart-type 6700) vers 27, 7 sites en moyenne (écart-type 3).
Sur le site https://www.azollacontrol.com/, qui rassemble diverses informations sur Azolla et son contrôle biologique, il est possible en Grande-Bretagne de commander ce charançon par packs et selon les superficies à traiter (3 formats de packs sont proposés : pour des superficies de 10, 50 et 100 m², avec un tarif allant de 100 £ à 395 £). Pour des superficies importantes, le client est invité à les contacter directement pour définir des modalités de contrôle possible.
Des informations récentes donnent quelques indications « locales » sur l’efficacité de ce contrôle. Par exemple, en 2020, des charançons ont été relâchés sur différentes sections du canal d’Erewash (un canal du Derbyshire long de 19 km proche de Nottingham) et le pourcentage de couverture de la fougère aquatique a considérablement diminué en moins de 2 semaines, avec une éradication complète sur certains tronçons. Aucune réapparition de la plante n’a été signalée sur ce canal jusqu’en 2021.
De même, des lâchers de charançons ont été faits sur plusieurs voies d’eau dans les Midlands dans le cadre du projet « Canal & River Invasive Species Eradication Project » (CRISEP 2021-2025). En 2021, alors que les colonisations par A. filiculoides couvraient des sections avec différents niveaux de densité sur un linéaire de 12 km, 8 semaines après l’introduction de charançons d’une valeur de 2 100 £, 58 % des sites présentaient un contrôle complet ou presque complet d’A. filiculoides. En 2022, tous les sites ont été contrôlés et un petit nombre de lâchers complémentaires de charançons sur des sites spécifiques ont seuls été nécessaires (Hughes, 2023, unpublished).
| N.B. : le montant total d’achat des charançons cité par Hughes correspondrait à une commande d’un peu plus de cinq « Large weevil pack« , un pack suffisant pour un contrôle de 100 m² d’Azolla (consultation du site https://www.azollacontrol.com/ le 5 août 2023). |
Des évaluations financières des modes de gestion des EEE : exemple de A. filiculoides vs S. rufinasus.
Depuis plusieurs décennies, au fur et à mesure que se sont accrus les dommages causés aux écosystèmes et aux usages des milieux par les plantes aquatiques exotiques envahissantes, des évaluations des dépenses d’interventions de gestion permettant de réduire ou d’annuler ces dommages se sont faites plus fréquentes et plus précises, devenant nécessaires par l’ampleur grandissante des montants financiers à leur consacrer et des difficultés rencontrées pour assurer ces financements dans des contextes économiques contraints.
Dans un premier temps, la plupart des bilans financiers généraux étaient établis pour des territoires spécifiques, comprenant des données détaillées par espèce (comme le cas de la France, dans la publication de Renault et al., 2021). Par la suite, ces évaluations se sont concentrées sur une espèce particulière pour mener des analyses comparatives des diverses approches techniques et/ou organisationnelles pour sa gestion, en prenant aussi en compte les possibilités de contrôle biologique dans différentes circonstances.
|
La base InvaCost Pour mieux appréhendes ces dépenses, la base de données mondiale InvaCost a permis de compiler des milliers de données sur les coûts engendrés par les espèces exotiques envahissantes et leur gestion a été créé (Diagne et al., 2020) et les mettre ainsi à disposition des chercheurs. Régulièrement mises à jour, une « figure vivante », liée à la dernière version d’InvaCost, permet d’accéder aux dernières évolutions de la base : Global Costs of Biological Invasions: Living Figure (borisleroy.com) |
Concernant Azolla filiculoides et son consommateur/adversaire Stenopelmus rufinasus, une analyse comparative a pu être établie en Afrique du Sud : les travaux de McConnachie et al. (2003) ont présenté une première comparaison des dépenses respectives des interventions traditionnelles de gestion de la plante (applications d’herbicides en particulier) et de la mise en œuvre de contrôle biologique par Stenopelmus rufinasus, et des indications sur les rapports coûts-avantages de ces techniques de gestion.
Pour la période 1995-2000, à partir de données de coûts moyens par hectare et par an du programme de lutte biologique, d’hypothèses sur la dispersion ultérieure de la plante et sur l’évolution des coûts de ce programme de lutte biologique, les rapports coûts-avantages du contrôle biologique versus le recours aux herbicides pour le contrôle d’Azolla en Afrique du Sud, étaient évalués à 2,5:1 pour l’an 2000, 13:1 en 2005 et 15:1 en 2010.
Des évaluations plus récentes de Maluleke et al. (2021), intégrant trois modalités techniques et deux scénarios d’application des herbicides selon les milieux à traiter, estiment que, pour l’Afrique du Sud, les coûts-avantages du contrôle biologique de la plante par S. rufinasus varient d’environ 30:1 à plus de 200:1 (coût annuel du contrôle biologique 957 000 Rand contre 30,6 à 206,7 millions de Rand selon la méthode d’application des herbicides).
La publication de Pratt et al. (2022) vient apporter un complément tout à fait important en termes de comparaison de dépenses dans un contexte où une simple approche « avant/après » n’est pas possible puisque les deux espèces sont présentes en Grande-Bretagne depuis des décennies : Pratt, C. F., Constantine, K., & Wood, S. V. (2022). A century of Azolla filiculoides biocontrol: the economic value of Stenopelmus rufinasus to Great Britain. CABI Agriculture and Bioscience, 3(1), 1-14.
A l’échelle du pays, faute de données comparatives disponibles, il était nécessaire de tenter une approche par scénarios, intégrant les données acquises sur A. filiculoides et ses capacités de colonisation dans le contexte climatique de la Grande-Bretagne, la diversité des milieux aquatiques favorables et la gestion de ces milieux en fonction des besoins humains, et enfin les résultats acquis depuis maintenant près de deux décennies sur le recours à S. rufinasus dans diverses situations.
Propositions de scénarios
Les auteurs ont déterminé trois scénarios pour estimer la valeur potentielle de ce contrôle biologique :
- Le premier, théorique, serait un scénario dans lequel A. filiculoides est effectivement arrivée en Grande-Bretagne au XIXe siècle mais où S. rufinasus n’aurait jamais été introduit. Connaissant les capacités de colonisation d’A. filiculoides sur une grande partie de la Grande-Bretagne, elle serait devenue très largement dominante dans de nombreux milieux aquatiques et aurait nécessité des besoins de gestion très réguliers. Dans l’extrapolation des coûts sont décrits des scénarios de gestion effectués une ou deux fois par saison, utilisant des approches chimiques, manuelles et mécaniques.
- Le deuxième scénario se réfère à la situation qui prévalait avant les lâchers réguliers de S. rufinasus effectués par CABI à partir du milieu des années 2000. S. rufinasus est présent en Angleterre depuis au moins 1921 et, après un siècle de présence, dans la majeure partie de l’aire de répartition d’A. filiculoides. Selon ce scénario, des populations de charançons naturalisés réduisent largement la dominance d’A. filiculoides, de nombreuses colonisations n’atteignent pas des niveaux élevés de couverture ou de densité créant des blocages étendus, la désoxygénation et la perte de biodiversité. La plupart des populations de la plante peuvent alors être maîtrisées sans être activement gérées, ce qui amène à une limitation des interventions, d’autant que les approches classiques, manuelles, mécaniques et chimiques, ne montrent pas de pleine efficacité.
- Le troisième scénario s’appuie sur la situation actuelle dans laquelle depuis le milieu des années 2000 le CABI a procédé à des lâchers réguliers de S. rufinasus avec une augmentation de la production vers 2010). A partir de 2010, le CABI a régulièrement expédié des charançons vers divers sites en Grande-Bretagne avec une moyenne annuelle 2011-2020 de 43 000 ± 6700 (erreur standard) individus à destination de 27,7 ± 3 (erreur standard) sites. Dans ce scénario, les populations de charançons ont donc été augmentées par des lâchers ciblés d’un grand nombre d’individus sur des sites largement répartis sur le territoire où d’importantes colonisations d’A. filiculoides étaient observées.
Les auteurs notent également que ces lâchers supplémentaires sont utilisés pour une proportion significative des colonisations mais que l’utilisation des méthodes traditionnelles de contrôle d’A. filiculoides est encore le fait de gestionnaires n’ayant pas encore pris conscience de l’intérêt du biocontrôle ou ayant besoin d’une élimination rapide des colonisations (par exemple pour des exigences de sécurité publique) ne pouvant pas attendre les 8-12 semaines d’action efficace du charançon.
Démarche de calcul des coûts de gestion
Pour chaque scénario, ont été établies des estimations du taux possible de colonisation par A. filiculoides, de la proportion de ces colonisations déclenchant des interventions, et des coûts engendrés par unité de longueur/superficie pour différents systèmes d’eau douce, c’est-à-dire rivières et ruisseaux, canaux de transport et d’alimentation, canaux de drainage, lacs et étangs, et fossés.
Des évaluations de l’importance des applications de méthodes « traditionnelles » de contrôle dans les deux premiers scénarios ont également été faites, ainsi que leurs coûts par unité de linéaire ou de superficie. Il en a été de même pour le coût du contrôle biologique dans le troisième scénario. Enfin, d’autres hypothèses portant sur les proportions de colonisations d’A. filiculoides visées par des interventions de gestion selon les usages des milieux ont également été formulées.
Cette partie de la publication présente assez longuement hypothèses et évaluations quantitatives, y compris financières, qui permettent de conforter les estimations ultérieurement calculées. Les lecteurs désireux d’en avoir une présentation plus complète permettant une appréciation mieux étayée de la qualité globale de cette analyse pourront en prendre connaissance : complément d’article « Démarche de calcul des coûts de gestion ».
Mode de calcul
La formule utilisée a été la suivante :
![]()
Les estimations des coûts annuels se réfèrent à un scénario d’année moyenne et la fourchette de gestion annuelle ou semestrielle reflète la variation potentielle des exigences de gestion d’une année à l’autre.
Résultats
Les coûts annuels totaux de la gestion d’A. filiculoides selon les trois scénarios proposés sont présentés dans le tableau 4 de la publication (non détaillé ici).
– Dans le premier scénario (absence en Grande-Bretagne de S. rufinasus), la gestion d’A. filiculoides reposerait seulement sur des méthodes « traditionnelles » de gestion. Les évaluations des coûts sont estimées à 8,4 à 16,9 millions £, la fourchette de montant étant liée à une gestion annuelle ou biannuelle.
– Dans le deuxième scénario (populations largement naturalisées de S. rufinasus mais avec des interventions « traditionnelles » encore fréquentes), le coût annuel de la gestion est estimé à 0,8 à 1,6 million £. Cela correspond à la situation se présentant avant l’élevage en masse et les lâchers de S. rufinasus par le CABI.
– Dans le troisième scénario (l’actuel : populations naturalisées de S. rufinasus sont complétées par des lâchers de charançons ciblant les colonisation d’A. filiculoides), le coût de la gestion est estimé entre 31,5 et 45,8 milliers £.
Les économies résultant du contrôle théorique à grande échelle d’A. filiculoides par des populations naturalisées de S. rufinasus, comparées à des coûts de gestion traditionnels estimés dans le cas d’une invasion massive et généralisée d’A. filiculoides en Grande-Bretagne (telle que cela a été le cas en Afrique du Sud), peuvent être évaluées et se situeraient entre 7,7 et 15,3 millions £ par an.
En comparant les économies de coûts de gestion réalisées en effectuant des lâchers annuels de S. rufinasus, dont le coût est établi, avec les coûts de gestion estimés dans le cadre du deuxième scénario, avec une population de charançons naturalisée, mais pas de lâchers supplémentaires, il est possible d’estimer le rapport coût-bénéfice de ces lâchers. Le coût annuel moyen des lâchers de renforcement (2011-2020) est de 17 146 £ ± 2633 (erreur standard), et les économies estimées en termes de réduction des coûts de gestion totaux résultant de ces lâchers de renforcement vont de 748 953 à 1 515 055 £ par an, ce qui donne un rapport bénéfices/coûts allant de 43,7:1 à 88,4:1.
Discussion et conclusions
Les auteurs de la publication rappellent que les coûts établis dans les trois scénarios utilisés sont indicatifs, donnant des estimations de dépenses potentielles. Pour le troisième scénario, ils indiquent qu’il est possible d’être confiant sur ces estimations (« it is possible to be confident in the magnitude of cost estimates« ), basées sur les dépenses liées aux méthodes traditionnelles de gestion de l’espèce, après consultation de diverses parties prenantes, et sur les dépenses liées aux lâchers supplémentaires de S. rufinasus, pour lesquels le CABI détient des archives.
Ils rappellent les montants très importants des coûts potentiels, dépassant annuellement 15 millions £, d’une gestion d’A. filiculoides qui aurait probablement dû se mettre en place en l’absence du charançon (scénario 1) à cause de la très forte colonisation possible de la plante sur le territoire. Ils signalent également les conséquences négatives sur la biodiversité qu’auraient pu avoir dans ce scénario hypothétique les applications régulières et à grande échelle d’herbicides et des coûts non pris en compte dans les évaluations sur les loisirs par exemple.
En utilisant le scénario 1 comme référence, Ils notent que la dispersion de S. rufinasus en Grande-Bretagne, bien qu’inconnue précisément, sur laquelle s’appuie le scénario 2, permet d’évaluer que l’action de cet agent de biocontrôle réduirait les dépenses de gestion d’A. filiculoides d’environ 90 %. Par ailleurs, ils notent également que les montants évalués dans le scénario 3, 0,8 à 1,6 million £ de dépenses annuelles, sont assez comparables en ordre de grandeur aux données de Williams et al. (2010) estimant le coût de la gestion des voies navigables de plusieurs EEE dont A. filiculoides à 3 millions £ par espèce et par an.
La réduction des coûts de gestion d’A. filiculoides calculée dans le scénario trois indique que, bien que les populations de charançons naturalisés aient un impact majeur sur la plante, les lâchers de S. rufinasus sont à la fois utiles et très rentables, avec des économies réalisées nettement plus importantes que le coût annuel d’achat de charançons (environ 20 000 £). Cette évolution des méthodes de gestion de la plante peut contribuer à la réduction des applications d’herbicides et, en limitant les développements d’A. filiculoides, favoriser des améliorations de la biodiversité des milieux.
| N.B. : en complément des informations sur l’exemple présenté par Hughes (2023, unpublished) concernant des colonisations traitées en 2021 par S. rufinasus dans des canaux du Midland (projet CRISEP), les coûts d’une extraction mécanique par bateau de ces colonisations étaient estimés à 12 600 £ (contre 2100 £ de charançons achetés au CABI). Il était également indiqué qu’au moins une répétition de cette intervention aurait peut-être été nécessaire. Les remarques sur ce point précisaient même que cette estimation de dépenses ne tenait pas compte des conditions d’accès aux sites et de l’élimination de la biomasse extraite. |
Les auteurs indiquent également que le rapport coût-bénéfice des lâchers de S. rufinasus pourrait augmenter avec le temps, au fur et à mesure que les populations naturalisées sont stimulées par des lâchers réguliers du charançon sur les colonisations d’A. filiculoides et que l’application du biocontrôle comme méthode de contrôle se généralise, réduisant potentiellement le nombre de sites de colonisations mal contrôlées ou laissées sans traitement, sources de propagules toujours disponibles.
Enfin, ils rappellent que dans les conditions climatiques actuelles le développement des populations de charançons est probablement limité mais que le changement climatique et le réchauffement des eaux pourraient amener à de meilleures conditions de développement et de reproduction du charançon. Ce pourrait se manifester par un accroissement du nombre possible de générations dans l’année, y compris avec des hivers doux permettant la survie des individus lâchés. Le contrôle d’A. filiculoides pourrait alors être plus complet, comme en Afrique du Sud où des lâchers continus de charançons ne semblent plus nécessaires.
Ils terminent en indiquant que leur présente étude n’a pas évalué l’ensemble des impacts positifs potentiels sur divers usages des milieux, dont les loisirs, et sur la biodiversité. Par exemple, les répercussions positives possibles de la régulation des populations d’A. filiculoides sur les activités de loisirs, les systèmes de drainage et les risques d’inondations, ou encore sur les dépenses consacrées à la préservation de la biodiversité des milieux aquatiques, n’ont pas été incluses dans leur analyse. De plus, ils n’ont pas évalué les économies potentielles résultant des méthodes traditionnelles de gestion, du biocontrôle conventionnel et des lâchers supplémentaires de biocontrôle en renfort. La prise en compte de ces données aurait pour effet d’accroître davantage les estimations des coûts et des économies potentielles engendrées par les diverses approches de gestion.
Quelques commentaires
Les travaux menés par le CABI sur les potentialités de recours au contrôle biologique de diverses plantes exotiques envahissantes des milieux aquatiques ont déjà fait l’objet d’articles disponibles sur le site du Centre de ressources, comme par exemple sur la Crassule de Helms et l’acarien Aculus crassulae, la Balsamine de l’Himalaya et la rouille Pucciana komarovii ou les renouées asiatiques et le psylle Aphalara itadori mais plusieurs autres plantes aquatiques exotiques envahissantes font également l’objet de recherches de cet organisme engagé à l’échelle mondiale sur de très nombreuses espèces exotiques impactant en particulier l’agriculture.
Par ailleurs, les récentes publications découlant du projet InvaCost sur les coûts des dommages et des interventions de gestion nécessaires pour gérer les EEE établies à l’échelle mondiale (voir le numéro spécial de la revue Néobiota n°67) et les perspectives d’augmentation de ces dépenses en lien avec le changement climatique sont autant d’incitations à examiner régulièrement les risques et avantages de ce recours à du contrôle biologique.
Le cas particulier de cette fougère et de son adversaire coléoptère semble déjà comporter de nombreuses informations validées permettant la mise en œuvre concrète présentée dans le contexte de la Grande-Bretagne dans des conditions que les responsables nationaux de la gestion ont dû juger acceptables.
Bien que l’analyse économique comparative de la présente publication est construite sur des hypothèses, celle-ci s’appuie sur des bases d’informations bien alimentées sur la diversité et les dimensions des biotopes favorables à la plante, à partir des connaissances disponibles sur son écologie, et sur les modalités techniques de gestion envisageables dans ces biotopes dans le contexte réglementaire du pays.
Le rassemblement de ces hypothèses dans trois scénarios différents a permis aux auteurs de proposer des évaluations financières qui restent bien sûr indicatives et discutables, d’autant que le scénario 1 est délibérément non vraisemblable (S. rufinasus est bien présent en Grande-Bretagne depuis un siècle).
Cependant, la publication nous semble comporter suffisamment de précisions sur le mode de construction de l’analyse, permettant d’arriver à des chiffres sur les taux de colonisations possibles par la plante et d’interventions de gestion dans les différents groupes de systèmes aquatiques examinés, et sur les coûts des modes de gestion, pour obtenir des évaluations chiffrées crédibles, constituer une base solide de réflexions et permettre son examen critique. Les scénarios proposés permettent d’établir des comparaisons par l’absurde et, d’une certaine manière, tenter d’évaluer (même tout à fait théoriquement, scénario 2) le rôle qu’a pu jouer le charançon avant qu’on se rende compte de son rôle dans une éventuelle régulation des populations de la fougère, semble lui donner une certaine valeur « écologique » dans la mise en œuvre en cours de cette approche, pour en faire un allié et pas seulement un moyen.
Le prosélytisme de nombreux interlocuteurs anglais sur le développement du contrôle biologique dans le domaine qui nous rassemble est bien connu et il semble que ces réflexions diffusent plus largement qu’en terre française. Par exemple, lors de la réalisation du présent article, ont été repérés deux documents concernant Azolla, édités par « Angling Trust« , l’organisation qui représente en Angleterre tous les pêcheurs. Un de ces documents est une fiche de présentation de l’espèce, rien que de très classique, l’autre, en revanche, présentée comme une fiche de gestion (« Management Guide« ), ne cite que « biological control using the Azolla weevil – Stenopelmus rufinasus« .
Pour terminer, tel qu’est présenté le scénario 1, il ne peut échapper à un lecteur de science-fiction que ce que proposent les auteurs de la publication scientifique à notre réflexion est une uchronie, c’est-à-dire une relecture de l’histoire, thème bien connu en fiction littéraire : et si Stenopelmus rufinasus n’était pas arrivé comme passager clandestin avec Azolla, transportée elle pour son intérêt esthétique en cette fin du XIXème siècle ? Et s’il avait fallu attendre les travaux réalisés en Afrique du Sud pour voir l’intérêt de ce petit coléoptère dans la gestion de la fougère qui n’est pas du tout restée confinée en Grande-Bretagne (comme ailleurs) ?
Mais construire une réflexion sur des hypothèses n’a rien de répréhensible en matière de recherche scientifique, dès lors que tous les éléments d’informations nécessaires permettant de comprendre la logique de son architecture sont présentés…
Rédaction : Alain Dutartre, expert indépendant
Relecture : Madeleine Freudenreich (Comité français de l’UICN)
Pour en savoir plus :
Références :
-
- Bedel L. 1901. Description et mœurs d’un nouveau genre de Curculionides de France. Bulletin de la Société Entomologique de France, 6 : 358–359.
- Diagne, C., Leroy, B., Gozlan, R. E., Vaissière, A. C., Assailly, C., Nuninger, L., … & Courchamp, F. (2020). InvaCost, a public database of the economic costs of biological invasions worldwide. Scientific data, 7(1), 277.
- Hill M. P., McConnachie J., Byrne M. J. 2008. Azolla filiculoides Lamarck (Pteridophyta: Azollaceae) control in South Africa: a 10-year review. Proceedings of the XII International Symposium on Biological Control of Weeds, La Grande Motte, France, 22–27 April, 2007. 558–560. https://doi.org/10.1079/9781845935061.0558.
- Janson O. E. 1921. Stenopelmus rufinasus Gyll., an addition to the list of British coleoptera. Entomol Mon Mag. 57:225–6.
- Lumpkin T. A., Plucknett D. L. 1980 Azolla: botany, physiology, and use as a green manure. Econ Bot. 34(2): 111–53.
- Maluleke M., Fraser G. C. G., Hill M. P. 2021. Economic evaluation of chemical and biological control of four aquatic weeds in South Africa. Biocontrol Sci Tech. 31(9):896–911. https://doi.org/10.1080/09583157.2021.1900783.
- McConnachie A. J., De Wit M. P., Hill M. P., Byrne M. J. 2003. Economic evaluation of the successful biological control of Azolla filiculoides in South Africa. Biol Control. 28(1):25–32. https://doi.org/10.1016/S1049-9644(03)00056-2.
- McConnachie A. J., Hill M. P., Byrne M. J. 2004.Field assessment of a frond-feeding weevil, a successful biological control agent of red waterfern, Azolla filiculoides, in southern Africa. Biol Control. 29(3):326–31. https://doi.org/10.1016/j.biocontrol.2003.08.010.
- Pratt C. F., Constantine K., Wood S. V., 2022. A century of Azolla filiculoides biocontrol: the economic value of Stenopelmus rufinasus to Great Britain. CABI Agriculture and Bioscience. 3:70, 14 pp. https://doi.org/10.1186/s43170-022-00136-0
- Pratt, C. F., Shaw, R. H., Tanner, R. A., Djeddour, D. H., Vos, J. G. M. 2013. Biological control of invasive non-native weeds: an opportunity not to be ignored. Entomologische Berichten, 73, 4, 144-154
- Reeder R. H., Bacon E. T. G., Caiden M. J., Bullock R. J., González-Moreno P. 2018. Effect of population density of the Azolla weevil (Stenopelmus rufinasus) on the surface cover of the water fern (Azolla filiculoides) in the UK. Biocontrol. 63(2):185–92. https://doi.org/10.1007/s10526-017-9861-5.
- Renals, T. (2014). Gestion des plantes exotiques envahissantes en Grande-Bretagne. Sciences Eaux & Territoires, 15, 34-37. https://doi.org/10.3917/set.015.0034
- Renault, D., Manfrini, E., Leroy, B., Diagne, C., Ballesteros-Mejia, L., Angulo, E., & Courchamp, F. (2021). Biological invasions in France: Alarming costs and even more alarming knowledge gaps. NeoBiota, 67, 191-224.
- Richerson P. J., Grigarick A. A. 1967. The life history of Stenopelmus rufinasus (Coleoptera : Curculionidae). Ann Entomol Soc Am. https://doi.org/10.1093/aesa/60.2.351.
- Roze M. E. 1883. Contribution à l’étude de la fécondation chez Azolla. Bull. Soc. Bot. Fr. 30, 198-206
- Williams F., Eschen R., Harris A., Djeddour D., Pratt C., Shaw R. S., Varia S., Lamontagne-Godwin J., Thomas S. E., Murphy S. T. 2010. The economic cost of invasive non-native species on Great Britain. Northampton: Edward Elgar Publishing; 199 pp.
Articles du Centre de ressources sur les travaux menés en Afrique du Sud :
- La difficile bataille contre les plantes exotiques envahissantes en Afrique du Sud (Dutartre, Septembre 2016)
- Situation des invasions biologiques et de leur gestion en Afrique du Sud (Dutartre, Février 2019)
- Invasions biologiques en Afrique du Sud (Dutartre, Avril 2020)

